
【题目】绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各环节都实现净化和无污染的反应途径。下列各项属于“绿色化学”的是( )。
A.处理废弃物 B.治理污染点
B.减少有毒物 D.杜绝污染源
科目:高中化学 来源: 题型:
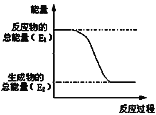
【题目】“西气东输”中的“气”指天然气,其主要成分的化学式是________,结构式是__________。一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1______E2(填“>”或“<”),该反应_______ (填“放出”或“吸收”)能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。
(1)基态锌原子的价电子排布式是_____________。
(2)根据元素周期律,电负性Se______S,第一电离能Se________As(填“>”或“<”)。
(3)H2Se的分子构型是___________,其中Se的杂化轨道类型是___________。
(4)H2O的沸点______________(填“>”或“<”)H2Se的沸点,其原因是:______。
(5)晶体Zn为六方最密堆积,其配位数是_______________。
(6)在硒化锌ZnSe晶胞中,Se2—离子作面心立方最密堆积,且Se2—与Se2—之间的最短距离为a nm,则晶胞边长为_____________ nm。
(7)假设阿伏伽德罗常数值为NA,则144g 硒化锌ZnSe晶体中的晶胞数是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
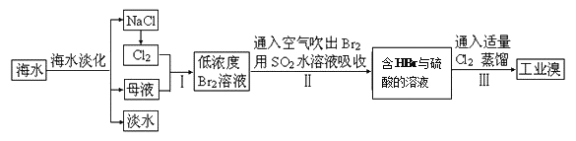
(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是__________。
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)制备钠单质的方法之一是将熔融NaCl进行电解,写出电解化学方程式:
______________________________________________________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是____________。写出步骤Ⅱ中发生反应的化学方程式:_______________________________________________。
(4)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59 ℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:
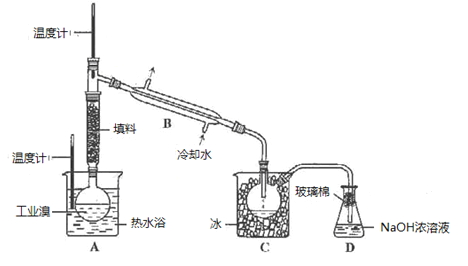
①图中仪器B的名称是________,冷却水的出口为____(填“甲”或“乙”)。
②C中液体的颜色为__________________。
③D装置的作用是__________________。
(5)已知某溶液中Cl-、Br-、I-的物质的量之比为2∶3∶4,现欲使溶液中的Cl-、Br-、I-的物质的量之比变成4∶3∶2,那么要通入Cl2的物质的量是原溶液中I-的物质的量的________。(填选项)
A.![]() B. C.
B. C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干冰和二氧化硅晶体同属ⅣA族元素的最高价氧化物,它们的熔、沸点差别很大的原因是
A. 二氧化硅相对分子质量大于二氧化碳相对分子质量 B. C—O键键能比Si—O键键能小
C. 干冰为分子晶体,二氧化硅为原子晶体 D. 干冰易升华,二氧化硅不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是
A.SO2、SiO2、CO均为酸性氧化物
B.碳酸、次氯酸、亚硫酸均为弱电解质
C.烧碱、冰醋酸、四氯化碳均为电解质
D.氯化钠溶液、硫酸均为强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁一次氯酸钠热料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是
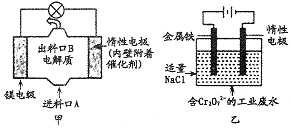
A. 图甲中发生的氧化反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2
B. 图乙中惰性电极棒上有02放出
C. 图乙中Cr2O72-向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去
D. 若图甲中3.6g镁产生的电量用于图乙废水处理,理论上图乙中有8.4g阳极材料参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】增强铝的耐腐蚀性,现以铅蓄电池以外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使表面表面的氧化膜增厚。反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(I)
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-═Pb2++2H2O | 阳极:2Al+3H2O-6e-═Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是
碱性氧化物 | 酸 | 盐 | |
A | CO2 | HCl | Na2CO3 |
B | CaO | NaHSO4 | KNO3 |
C | Al2O3 | HNO3 | CuSO4 |
D | MgO | H2SO4 | ZnCl2 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com