
| A. | Q2>2 Q1 | B. | Q1=92.4 kJ | C. | Q1<Q2<184.8 kJ | D. | Q1=Q2<92.4 kJ |
分析 热化学方程式N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol表示一定条件下,1molN2(g)与3molH2(g)反应生成2molNH3(g)放出的热量是92.4kJ.恒温恒压下,反应前后气体的物质的量发生变化,①与②中n(N2):n(H2)=1:3,二者为等效平衡,反应物的转化率相同,②中参加反应的n(N2)是①中的2倍,据此判断.
解答 解:热化学方程式N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol表示一定条件下,1molN2(g)与3molH2(g)反应生成2molNH3(g)放出的热量是92.4kJ.
反应为可逆反应,物质不能完全反应,恒温恒压下,反应前后气体的物质的量发生变化,①与②中n(N2):n(H2)=1:3,二者为等效平衡,反应物的转化率相同,②中参加反应的n(N2)是①中的2倍,所以Q2=2 Q1<184.8 kJ.
故选:C.
点评 本题考查热化学方程式的意义、反应热的计算、可逆反应特征、等效平衡等,难度中等,注意掌握等效平衡规律、理解热化学方程式意义.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜片放入稀硫酸中:Cu+2H+═Cu2++H2↑ | |
| B. | 将铁粉放入氯化铜溶液中:Fe+Cu2+═Fe2++Cu | |
| C. | Ba(OH)2溶液中滴入MgCl2溶液中:2OH-+Mg2+═Mg(OH)2↓ | |
| D. | 纯碱中滴加盐酸:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示.下列说法正确的是( )
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示.下列说法正确的是( )| A. | A、B两酸溶液的物质的量浓度一定相等 | |
| B. | 稀释后,A酸溶液的酸性比B酸溶液强 | |
| C. | a=5时,A是强酸,B是弱酸 | |
| D. | 若a小于5,则A、B都是弱酸,且A的酸性弱于B |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
甲、乙、丙、丁分别是氢氧化钙溶液、硝酸钾溶液、碳酸钠溶液、盐酸中的一种。已知甲和丙可以反应,甲和丁也可以反应,则下列说法正确的是
A.甲一定是氢氧化钙溶液 B.乙一定是硝酸钾溶液
C.丙不可能是碳酸钠溶液 D.丁只能是盐酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列变化中,属还原反应的是
A.Cl-→Cl2 B.FeCl2→FeCl3 C.C→CO2 D.KMnO4→MnO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
下列叙述中正确的是
A.1molO2的质量是32g·mol-1
B.SO 4 2 - 的摩尔质量为 96 g·mol-1
C.1摩尔任何物质的质量等于该物质的相对分子质量
D.CO2的摩尔质量是44g
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
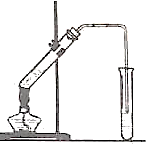 如图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com