
| A. | 得出完整的元素周期表 | B. | 发现了元素周期律 | ||
| C. | 发现空气的组成 | D. | 提出原子、分子学说 |
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 产品在溶剂中的溶解度随温度升高而迅速增大 | |
| B. | 在溶剂中产品比杂质更难溶解 | |
| C. | 杂质在溶剂中的溶解度在高温或低温时都很大 | |
| D. | 室温时产品在溶剂中很易溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
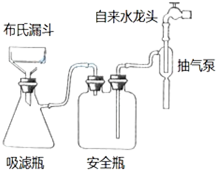 某学生预测定味精(味精的主要成分化学式为C5H8NO4Na•H2O)中食盐的含量,做了如下实验:
某学生预测定味精(味精的主要成分化学式为C5H8NO4Na•H2O)中食盐的含量,做了如下实验: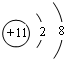 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
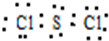 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=(+283.0kJ/mol)×2 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阿司匹林有解热阵痛的作用 | |
| B. | 服用阿司匹林后出现肠胃道反应是中毒的表现,应立即停药 | |
| C. | 阿司匹林在干燥空气中不稳定,所以通常制成肠溶片 | |
| D. | 阿司匹林有治疗癌症的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com