
| A. | 0.3 mol/L | B. | 0.15 mol/L | C. | 0.25 mol/L | D. | 无法计算 |
分析 n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,n(NO3-)=0.02mol,n(H+)=0.2mol/L×0.1L+0.1mol/L×2×0.1L=0.04mol,结合3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O先判断过量,再结合反应计算.
解答 解:n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,n(NO3-)=0.02mol,n(H+)=0.2mol/L×0.1L+0.1mol/L×2×0.1L=0.04mol,
由3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
0.03 0.02 0.08
可知氢离子不足,完全反应,n(Cu2+)=0.04mol×$\frac{3}{8}$=0.015mol,
完全反应后溶液中Cu2+的物质的量浓度为$\frac{0.015mol}{0.1L}$=0.15mol/L,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的氧化还原反应、物质的量的相关计算为解答的关键,侧重分析与计算能力的考查,注意过量判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态 | |
| B. | 对于上述平衡,加人适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 | |
| C. | 第②步中,还原 0.1molCr2O72-需要45.6gFeSO4 | |
| D. | 第③步沉淀剂a可以使用NaOH等碱性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8 g | B. | 5.6 g | C. | 11.2 g | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
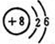
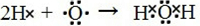
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
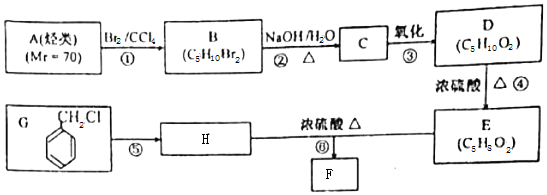
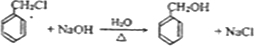 .
. .
.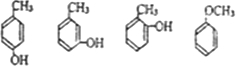 写出其中一种.
写出其中一种.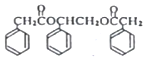 .(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)
.(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)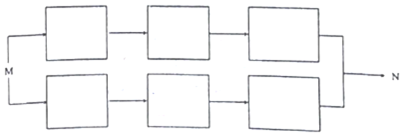
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率为v(PCl3)=0.0016mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L-1,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com