
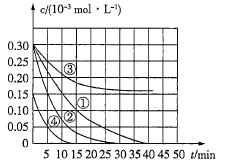
【题目】电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线②代表滴定CH3COOH溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C三点溶液中水的电离程度: A<C<B
D. D点溶液中:c(Cl-)+ 2c(H+)=2c(OH-)
【答案】D
【解析】
溶液导电能力与离子浓度成正比,CH3COOH是弱电解质,溶液中离子浓度较小,加入NaOH后,溶液中离子浓度增大,溶液导电性增强;HCl是强电解质,随着NaOH溶液加入,溶液体积增大,导致溶液中离子浓度减小,溶液导电能力减弱,当完全反应时离子浓度最小,继续加入NaOH溶液,离子浓度增大,溶液导电能力增强,根据图知,曲线②代表0.100 mol·L-1的NaOH溶液滴定HCl溶液的滴定曲线,曲线①代表0.100 mol·L-1的NaOH溶液滴定CH3COOH溶液的滴定曲线,据此解答。
A.由分析可以知道,曲线②代表0.100 mol·L-1的NaOH溶液滴定HCl溶液的滴定曲线,故A错误;
B.A点溶液中c(Na+)=0.05mol/L,电解质溶液中都存在电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)-c(H+)=c(Na+)=0.05mol/L,故B错误;
C.酸或碱抑制水电离,含有弱离子的盐促进水电离,C点溶质为NaCl,A点溶质为醋酸钠,促进水电离,B点为等物质的量浓度的醋酸钠和NaOH,NaOH会抑制水的电离,所以在相同温度下,水的电离程度:B<C<A,故C错误;
D. D点溶液中,存在电荷守恒,c(Cl-)+c(OH-)=c(Na+)+c(H+),定量分析可以知道, c(Na+)=1.5c(Cl-),将电荷守恒式中c(Na+)代换为c(Cl-)并整理得:c(OH-)=0.5c(Cl-)+c(H+),即c(Cl-)+ 2c(H+)=2c(OH-),所以D选项是正确的;
综上所述,本题正确答案为D。


科目:高中化学 来源: 题型:
【题目】已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同的密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是
A.Q1=2Q2=92.4B.Ql>2Q2C.Q1<2Q2D.Q1=2Q2≠92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiC有两种晶态变体:α—SiC和β—SiC。其中β—SiC为立方晶胞,结构与金刚石相似,晶胞参数为434pm。针对β—SiC回答下列问题:
⑴C的配位数为__________。
⑵C和Si的最短距离为___________pm。
⑶假设C的原子半径为r,列式并计算金刚石晶体中原子的空间利用率_______。(![]()
![]() π =3.14)
π =3.14)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究其降解效果,设计如下对比实验探究温度、浓度、pH对降解速率和效果的影响,实验测得M的浓度变化与时间的关系如图所示,下列说法不正确的是( )
实验编号 | 温度(K) | pH |
① | 298 | 1 |
② | 310 | 1 |
③ | 298 | 7 |
④ | 298 | 2 |
A.实验①在15min内M的降解速率为1.33×10-5mol·L-1·min-1
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.若其他条件相同,实验①④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量且足量的两份锌a、b,分别加入等量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列各图表示产生H2的体积(V)与时间(t)的关系,其中正确的是 ( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下:
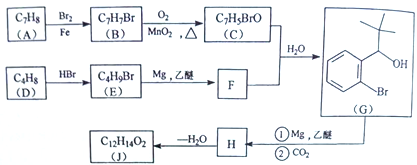
己知: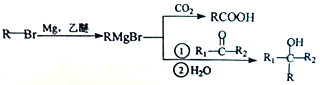
(1)G中官能团的名称为_________、_________。
(2)D的系统命名是_________。
(3)由A生成B的化学方程式为_________,反应类型_________。
(4)C与银氨溶液反应的化学方程式为________________________。
(5)H在一定条件下生成高分子化合物的结构简式为_________。
(6)写出一种同时满足下面条件的G的同分异构体的结构简式_________。
①核磁共振氢谱有4组峰②能与FeCl3溶液发生显色反应
(7)借助题中信息写出以乙醛和苯为原料,合成 的路线流程图(其它试剂自选)。_________________________________________________________。
的路线流程图(其它试剂自选)。_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25°C) | Ka=l. 77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5. 6×10-11 |
下列选项错误的是
A.向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2= 2HCN+CO32-
B.室温下,处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN)
C.中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
D.等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,“低碳经济”备受关注,![]() 的产生及有效开发利用成为科学家研究的重要课题.
的产生及有效开发利用成为科学家研究的重要课题.
![]() 向浓
向浓![]() 溶液中通入
溶液中通入![]() 和
和![]() ,可以制得纳米级碳酸钙
,可以制得纳米级碳酸钙![]() 粒子直径在
粒子直径在![]() 之间
之间![]() ①向浓
①向浓![]() 溶液中通人
溶液中通人![]() 和
和![]() 气体制纳米级碳酸钙时,应先通入
气体制纳米级碳酸钙时,应先通入![]() ,后通入
,后通入![]() 制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______ .
制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______ .
![]() 定条件下,
定条件下,![]() 和
和![]() 反应,能生成
反应,能生成![]() 和
和![]() 将
将![]() 和
和![]() 分别加入甲、乙两个密闭容器中,发生反应:
分别加入甲、乙两个密闭容器中,发生反应:![]() ,其相关数据如下表所示:
,其相关数据如下表所示:
容器 | 容积 | 温度 | 起始量 | 平衡量 | 达到平衡所需时间 | |
|
|
| ||||
甲 | 2 |
| 2 | 4 |
| 8 |
乙 | 1 |
| 1 | 2 |
| 3 |
①![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ______
______
②乙容器中,当反应进行到![]() 时,
时,![]() 的物质的量浓度 ______
的物质的量浓度 ______ ![]() 填选项字母
填选项字母![]() .
.
A.![]()
![]()
![]()
![]()
③丙容器的容积为1L,![]() 时,起始充入amol
时,起始充入amol![]() 和bmol
和bmol![]() ,反应达到平衡时,测得
,反应达到平衡时,测得![]() 的转化率大于
的转化率大于![]() 的转化率,则
的转化率,则![]() 的值需满足的条件为 ______ ;
的值需满足的条件为 ______ ;
④丁容器的容积为1L,![]() 时,按下列配比充入
时,按下列配比充入![]() 、
、![]() 、
、![]() 和
和![]() ,达到平衡时各气体的体积分数与甲容器完全相同的是 ______
,达到平衡时各气体的体积分数与甲容器完全相同的是 ______ ![]() 填选项字母
填选项字母![]() .
.
A.![]() 、
、![]() 、
、![]() 、
、![]()
B.![]() 、
、![]() 、O
、O
C.![]() 、
、![]() 、
、![]() 、
、![]()
D.![]() 、
、![]() 、
、![]() 、
、![]()
![]() 在一定条件下可转化为甲醚
在一定条件下可转化为甲醚![]() 用甲醚燃料电池做电源,用惰性电极电解饱和
用甲醚燃料电池做电源,用惰性电极电解饱和![]() 溶液可制取
溶液可制取![]() 和KOH,实验装置如图所示
和KOH,实验装置如图所示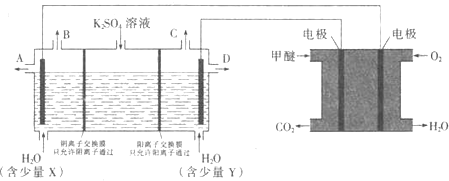
①甲醚燃料电池的负极反应式为 ______
②![]() 口导出的物质为 ______
口导出的物质为 ______ ![]() 填化学式
填化学式![]() .
.
③若燃料电池通入![]() 的速率为
的速率为![]() ,2min时,理论上C口收集到标准状况下气体的体积为 ______ .
,2min时,理论上C口收集到标准状况下气体的体积为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.C5H10共有8种同分异构体(不考虑立体异构)
B. 的名称为3-甲基丁烷
的名称为3-甲基丁烷
C.CH3COOCH2CH3 和CH3CH2COOCH3互为同分异构体
D.苯甲醇和苯酚互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com