


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

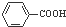 和
和 为原料制备
为原料制备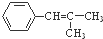 的合成路线流程图(无机试剂任用).合成路线流程图示例如图:
的合成路线流程图(无机试剂任用).合成路线流程图示例如图:| NaOH溶液 |
| △ |
| CH3COOH |
| 浓硫酸△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、69g | B、66g |
| C、85g | D、89g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓碱飞溅到皮肤上,应立刻涂上硫酸溶液 |
| B、金属钠着火,立刻用水扑灭 |
| C、加热试管前,先来回移动酒精灯加热,再对准药品集中加热 |
| D、氢气还原氧化铜,先加热固体,再通入氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com