
| A. | 使用催化剂能加快反应速率 | |
| B. | 压强增大不影响化学反应速率 | |
| C. | 冬天气温低,反应速率降低,对人类危害减小 | |
| D. | 无论外界条件怎样改变,均对此化学反应的速率无影响 |
分析 A.催化剂能增大活化分子的百分数,反应速率增大;
B.有气体参见反应,改变压强时,反应速率改变;
C.降低温度可减慢反应速率,NO和CO对人的危害远大于N2和CO2;
D.当改变外界条件,活化分子的浓度或百分数发生改变时,化学反应速率改变.
解答 解:A.催化剂可以改变化学反应速率,我们通常所说的催化剂一般都指正催化剂,能加快反应速率,故A正确;
B.增大压强,可以使气体物质的体积变小,其浓度变大,所以反应速率加快,反之,减小压强,可使气体的体积变大,浓度变小,反应速率变慢,由于该反应是气体物之间的反应,改变压强,对反应速率有影响,故B错误;
C.升高温度,可以加快反应速率,降低温度可减慢反应速率.由于NO和CO对人的危害远大于N2和CO2,所以当NO与CO反应生成N2和CO2的速率降低时,对人危害更大.故C错误;
D.是一个气体物质间的化学反应,改变反应物的浓度、压强、温度均能改变该反应的速率,故D错误.
故选A.
点评 本题考查反应速率的影响,为高频考点,侧重于基本理论的理解和应用的考查,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:解答题
 在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1mol X和3mol Y,此时容积为V L.保持恒温恒压,发生反应X(g)+3Y(g)?2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5.
在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1mol X和3mol Y,此时容积为V L.保持恒温恒压,发生反应X(g)+3Y(g)?2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
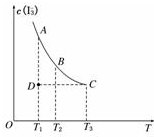 实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是( )
实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是( )| A. | 该反应的正反应是吸热反应 | B. | A点与C点的化学反应速率vA<vC | ||
| C. | 在反应进行到D点时,v正>v逆 | D. | A点与B点相比,B点的c(I2)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 称量时,左盘低,右盘高 | B. | 定容时俯视读取刻度 | ||
| C. | 原容量瓶洗净后未干燥 | D. | 定容时液面超过了刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- | |
| C. | $\frac{{k}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ba2+、Cl-、NO3- | |
| D. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2+Na2SO4═BaSO4↓+2NaOH | B. | BaCl2+Na2SO4═BaSO4↓+2NaCl | ||
| C. | BaCO3+H2SO4═BaSO4↓+CO2↑+H2O | D. | BaCl2+H2SO4═BaSO4↓+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱碱性溶液中:Na+、K+、Cl-、HCO3- | |
| B. | “84”消毒液中:SiO32-、CO32-、Na+、S2- | |
| C. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com