
(1)Ē¦Šīµē³ŲŌŚ·ÅµēŹ±µÄøŗ¼«·“Ó¦ĪŖ_________£®
ĘäŌŚ³äµēŹ±µÄŃō¼«·“Ó¦ĪŖ_________£®
(2)ÄųļÓ¼īŠŌ³äµēµē³ŲŌŚ³äµēŹ±µÄ×Ü·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_________£®
(3)ÉĻŹöĮ½ÖÖµē³ŲŹ¹ÓĆŅ»¶ĪŹ±¼äŗó£¬Ņ»øöÄŚ×čĆ÷ĻŌŌö“ó£¬ĮķŅ»øöÄŚ×čČ“¼øŗõ²»±äµÄÖ÷ŅŖŌŅņæÉÄÜŹĒ_________£®
| Éč¼ĘŅāĶ¼£ŗ±¾ĢāŅŌōĒ»ł±½¼×ĖįŅŅõ„µÄÖʱøĪŖĒŠČėµć£¬×ŪŗĻæ¼²éÓŠ»śĪļµÄÓŠ¹ŲÖŖŹ¶¼°Ń§ÉśµÄ·ÖĪöĶĘĄķÄÜĮ¦£¬Ķ¬Ź±æ¼²éѧɜĖ¼Ī¬µÄĮé»īŠŌ¼°ĘäĒØŅĘĖłŃ§ÖŖŹ¶µÄÄÜĮ¦£®
½āĪö£ŗ(1)±Č½Ļ¼×±½ŗĶ¶Ō¼×”Ŗ»ł±½·ÓµÄ½į¹¹æɵĆÖŖAµÄ½į¹¹ĪŖ
(2)·“Ó¦¢ŻĪŖĖįŗĶ“¼Ö®¼äµÄõ„»Æ·“Ó¦£¬õ„»Æ·“Ó¦ŠėŌŚĪŽ»śĒæĖįµÄĢõ¼žĻĀ½ųŠŠ£® (3)ÓÉ¢ŚµÄ·“Ó¦Ź½æÉÖŖ£¬·“Ó¦¢ŚĪŖČ”“ś·“Ó¦£¬·“Ó¦¢ÜŹĒ-CH3×Ŗ»ÆĪŖ-COOHµÄ·“Ó¦£¬ÓÉÓŚŹĒ¼ÓŃõµÄ·“Ó¦£¬¹ŹĪŖŃõ»Æ·“Ó¦£® (4)·ÖĪö (5)“ÓĢāÖŠæņĶ¼æÉŅŌ擳ö£¬·“Ó¦¢Ū°Ń·ÓōĒ»ł×Ŗ»ÆĪŖ-OCH3£¬¶ų·“Ó¦¢ŽÓÖ°Ń-OCH3»¹ŌĪŖ·ÓōĒ»ł£¬ĮŖĻė·ÓōĒ»ł²»ĪČ¶Ø£¬ŌŚæÕĘųÖŠ¾ĶŅ×±»Ńõ»ÆµÄŠŌÖŹ£¬ŌŁ½įŗĻ·“Ó¦¢ŪŗĶ¢ŽÖ®¼ä£¬ŌųÓŠ-CH3±»Ńõ»ÆĪŖ-COOHµÄ²½Öč£¬æÉĶĘ²ā³öÕāŃł×öµÄÄæµÄŹĒĪŖĮĖ±£»¤·ÓōĒ»ł²»±»Ńõ»Æ£® Ņדķµć£ŗŠ“ÓŠ»ś»Æѧ·“Ó¦·½³ĢŹ½Ź±£¬Ö»×¢Ņā¶ŌÓŠ»śÉś³ÉĪļµÄŹéŠ“£¬¶ųŗöĀŌĮĖŠ”·Ö×ӵď銓£®ČēŠ“¢ŻŹ±ŗöĀŌĮĖĖ®£¬Š“¢ŪŹ±ŗöĀŌĮĖHI£»Š“·“Ó¦Ź½¢ŻŹ±£¬Ć»ÓŠ×¢Ć÷·“Ó¦Ģõ¼ž£»»Ų“š(5)ĪŹŹ±£¬²»ÄÜ×Ū¹ŪČ«¾Ö£¬²¢ĮŖĻė·ÓĄąĪļÖŹµÄŠŌÖŹ¶ųĖ¼æ¼£¬ŅŌÖĀøŠµ½Ć»ÓŠĶ·Š÷¶ų“ķ“š»ņĀ©“š£® “š°ø£ŗ(1)
(5)±£»¤ōĒ»ł£¬±ÜĆāŌŚ¢Ü“¦±»Ńõ»Æ
|


 100·Ö“³¹ŲĘŚÄ©³å“ĢĻµĮŠ“š°ø
100·Ö“³¹ŲĘŚÄ©³å“ĢĻµĮŠ“š°ø ĆūŠ£ĮŖĆĖæģĄÖæĪĢĆĻµĮŠ“š°ø
ĆūŠ£ĮŖĆĖæģĄÖæĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
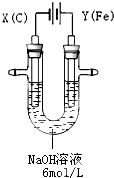 øßĢśĖį¼Ų£ØK2FeO4£©¾ßÓŠøߊ§µÄĻū¶¾×÷ÓĆ£¬ĪŖŅ»ÖÖŠĀŠĶ·ĒĀČøߊ§Ļū¶¾¼Į£®µē½ā·ØÖʱøøßĢśĖį¼Ų²Ł×÷¼ņ±ć£¬³É¹¦ĀŹøߣ¬Ņ×ÓŚŹµŃéŹŅÖʱø£®ĘäŌĄķČēĶ¼ĖłŹ¾£®
øßĢśĖį¼Ų£ØK2FeO4£©¾ßÓŠøߊ§µÄĻū¶¾×÷ÓĆ£¬ĪŖŅ»ÖÖŠĀŠĶ·ĒĀČøߊ§Ļū¶¾¼Į£®µē½ā·ØÖʱøøßĢśĖį¼Ų²Ł×÷¼ņ±ć£¬³É¹¦ĀŹøߣ¬Ņ×ÓŚŹµŃéŹŅÖʱø£®ĘäŌĄķČēĶ¼ĖłŹ¾£®| ³äµē | ·Åµē |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ·Åµē | ³äµē |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ·Åµē | ³äµē |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
| ·Åµē | ³äµē |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com