在MgCl2和AlCl3的混合溶液中,Cl-的物质的量为0.7mol.向该溶液中逐渐加入100mL 8mol?L-1 的KOH溶液,使之充分反应.反应前,若Al3+的物质的量与混合溶液中离子总物质的量的比值为x.(不考虑Mg2+和Al3+水解及水电离对离子数目的影响),请通过计算回答下列问题:
(1)x的取值范围是______;
(2)如溶液中的阳离子恰好完全沉淀需加入______ mL的KOH溶液;
(3)当100mL KOH溶液刚好完全消耗,且Al3+全部转化为AlO2-时,x的值为______.
解:(1)令溶液中Al
3+的物质的量为a mol,由电荷守恒可知Mg
2+的物质的量为

,溶液中离子总的物质的量为三种离子之和,也等于
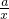
mol,故

+amol+0.7mol=
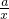
mol,解得a=

,由极限法可知0<a<

,故0<

<

,解得0<x<0.25,故答案为:0<x<0.25;
(2)溶液中的阳离子恰好完全沉淀,此时溶液中溶质为KCl,根据守恒可知n(KOH)=n(KCl)=n(Cl
-)=0.7mol,故KOH溶液是体积为

=0.0875L=87.5mL,故答案为:87.5;
(3)当100 mL KOH刚好完全消耗,且Al
3+全部转化为AlO
2-时,此时溶液中溶质为KCl、KAlO
2,根据守恒可知n(K
+)=n(Cl
-)+n(AlO
2-),故n(AlO
2-)=0.1L×8mol/L-0.7mol=0.1mol,故n(Al
3+)=0.1mol,根据电荷守恒可知,n(Mg
2+)=

=

=0.2mol,故x=

=0.1,故答案为:0.1.
分析:(1)令溶液中Al
3+的物质的量为a mol,利用电荷守恒用a表示出Mg
2+的物质的量,溶液中离子总的物质的量为三种离子之和,也等于
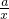
mol,据此列等式计算a的值(用x表示),利用极限法可知0<a<

,据此计算x的取值范围;
(2)溶液中的阳离子恰好完全沉淀,此时溶液中溶质为KCl,根据守恒可知n(KCl)=n(KOH)=n(Cl
-),据此计算KOH溶液是体积;
(3)当100 mL KOH刚好完全消耗,且Al
3+全部转化为AlO
2-时,此时溶液中溶质为KCl、KAlO
2,根据守恒可知n(K
+)=n(Cl
-)+n(AlO
2-),n(AlO
2-)=n(Al
3+),利用电荷守恒计算n(Mg
2+),据此计算x的值.
点评:本题考查混合物的有关计算,题目难度中等,注意利用守恒进行的计算,(1)为易错点,可以直接利用极限法分析判断x的最大值不能取等号.

 ,溶液中离子总的物质的量为三种离子之和,也等于
,溶液中离子总的物质的量为三种离子之和,也等于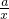 mol,故
mol,故 +amol+0.7mol=
+amol+0.7mol=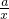 mol,解得a=
mol,解得a= ,由极限法可知0<a<
,由极限法可知0<a< ,故0<
,故0< <
< ,解得0<x<0.25,故答案为:0<x<0.25;
,解得0<x<0.25,故答案为:0<x<0.25; =0.0875L=87.5mL,故答案为:87.5;
=0.0875L=87.5mL,故答案为:87.5; =
= =0.2mol,故x=
=0.2mol,故x= =0.1,故答案为:0.1.
=0.1,故答案为:0.1.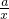 mol,据此列等式计算a的值(用x表示),利用极限法可知0<a<
mol,据此列等式计算a的值(用x表示),利用极限法可知0<a< ,据此计算x的取值范围;
,据此计算x的取值范围;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案