
| 时间(Min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
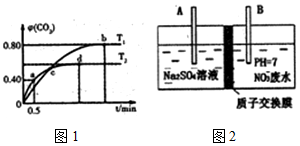
分析 (1)①不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,发生反应:5CO(g)+I2O5 (s)?5CO2(g)+I2(s),T2温度下,0.5min内CO2的物质的量分数变为0.40,根据化学反应平均速率公式$\overline{r}(C{O}_{2})=\frac{△n}{V△t}$计算,T1时,根据图象,代入气体组分的平衡会浓度计算化学反应平衡常数;
②反应5CO(g)+I2O5 (s)?5CO2(g)+I2(s)是气体数守恒的反应,压强变化不对化学平衡产生影响,d点时,向容器中再充人3molCO,相当于对反应加压,构成等效平衡;
(2)①发生反应C(s)+2NO(g)?N2 (g)+CO2(g),反应在30min时已经达到平衡,改变条件,NO,N2,CO2再次达到平衡时的浓度均增加,反应是一个气体数守恒的反应,据此判断分析;
②若50min后降低温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为1:l:l,升高温度前,平衡时NO、N2、CO2的浓度之比为4:3:3,表明降低温度,平衡向正反应方向移动,据此判断;
(3)工业上处理含氮废水采用如图2电解法将NO3-转化为N2,根据电极反应式和电子得失守恒,据此计算.
解答 解:(1)①不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,发生反应:5CO(g)+I2O5 (s)?5CO2(g)+I2(s),T2温度下,0.5min内CO2的物质的量分数变为0.40,根据物料守恒,n(CO)+n(CO2)=2mol,物质的量分数$φ(C{O}_{2})=\frac{n(C{O}_{2})}{n(CO)+n(C{O}_{2})}$,则平衡时,n(CO2)=2mol×0.40=0.8mol,反应经历的时间为△t=0.5min,CO2的物质的量改变量为△n=0.8mol,则0.5min内CO2的平均速率为$\overline{r}(C{O}_{2})=\frac{△n}{V△t}$=$\frac{0.8mol}{2L×0.5min}$=0.8mol/(L•min),
T1时,达到平衡时,φ(CO2)=0.80,则此时n(CO2)=2mol×0.80=1.6mol,根据反应关系,平衡时,c(CO2)=$\frac{1.6mol}{2L}=0.8mol/L$,c(CO)=$\frac{2mol-1.6mol}{2L}$=0.2mol/L,该温度下的化学平衡常数为K=$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$=$\frac{(0.8mol/L)^{5}}{(0.2mol/L)^{5}}$=1024,
故答案为:0.8mol/(L•min);1024;
②反应5CO(g)+I2O5 (s)?5CO2(g)+I2(s)是气体数守恒的反应,压强变化不对化学平衡产生影响,d点时,向容器中再充人3molCO,相当于对反应加压,构成等效平衡,平衡状态不发生改变,则CO2的百分含量不变,
故答案为:不变;
(2)①发生反应C(s)+2NO(g)?N2 (g)+CO2(g),反应在30min时已经达到平衡,改变条件,NO,N2,CO2再次达到平衡时的浓度均增加,反应是一个气体数守恒的反应,改变条件前,NO、N2、CO2的浓度比为4:3:3,改变条件后再次达到平衡时,NO、N2、CO2的浓度比仍为4:3:3,可知改变条件,并未改变化学平衡,则只有B项符合,
故答案为:B;
②若50min后降低温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为1:l:l,升高温度前,平衡时NO、N2、CO2的浓度之比为4:3:3,表明降低温度,平衡向正反应方向移动,则达到新平衡时NO的转化率升高,正反应为放热反应,则△H<0,
故答案为:升高;<;
(3)工业上处理含氮废水采用如图2电解法将NO3-转化为N2,反应过程中,H+通过质子交换膜参与反应,则该电极的电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O,25℃时,除去2L废水中的124mg NO3-,即除去NO3-的物质的量为n(NO3-)=$\frac{124×1{0}^{-3}g}{62g/mol}$=0.002mol,转移电子数为n(e-)=0.002mol×5=0.01mol,阳极的电极反应为:2H2O-4e-═4H++O2↑,根据电子得失守恒,阳极也应转移0.01mole-,则阳极产生n(H+)=0.01mol,阴极反应消耗H+的物质的量为0.002mol×6=0.012mol,可见需要H2O多电离出H+用于反应,则溶液中多出c(OH-)=$\frac{0.012mol-0.01mol}{2L}$=0.001mol/L,此时溶液的pH=14-pOH=14+lg0.001=11,
故答案为:11.
点评 本题考查化学原理部分知识,包含化学速率的计算,化学平衡的移动,等效平衡的原理,电化学原理,根据电子得失守恒计算,题目难度中等,(3)是易错点,注意H+的量不够,破坏水的电离平衡消耗H+,剩余OH-使溶液显碱性.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH2和 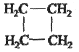 | |
| B. |  和 和 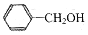 | |
| C. | 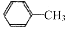 和 和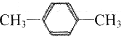 | |
| D. | CH2=CH-CH=CH2和CH3-CH2-CH2-C≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
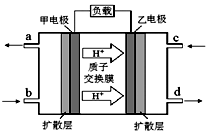 甲醇-空气燃料电池(DMFC)是一种高效、轻污染的车载电池,其工作原理如图.下列有关叙述正确的是( )
甲醇-空气燃料电池(DMFC)是一种高效、轻污染的车载电池,其工作原理如图.下列有关叙述正确的是( )| A. | 该装置能将电能转化为化学能 | |
| B. | 电流由乙电极经导线流向甲电极 | |
| C. | 负极的电极反应式为:CH3OH+6OH--6e-=CO2+5H2O | |
| D. | b口通入空气,c口通入甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
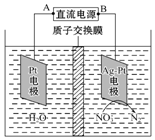 化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示.下列说法不正确的是 (相对原子质量 O-16)( )
化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示.下列说法不正确的是 (相对原子质量 O-16)( )| A. | A为电源的正极 | |
| B. | 溶液中H+从阳极向阴极迁移 | |
| C. | Ag-Pt电极的电极反应式为2NO3-+12H++10e-═N2↑+6H2O | |
| D. | 电解过程中,每转移2 mol电子,则左侧电极就产生32gO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化/kJ | ||
| N2 | H2 | NH3 | |||
| a | 1 | 4 | 0 | t1 min | 放出热量:36.88kJ |
| b | 2 | 8 | 0 | t2 min | 放出热量:Q |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
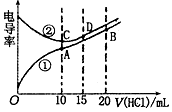 电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氮相似,常温Kb[(CH3)2NH]=1.6×10-4.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氮相似,常温Kb[(CH3)2NH]=1.6×10-4.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线②代表滴定二甲胺溶液的曲线 | |
| B. | A点溶液中:c(H+)=c(OH-)+c[(CH3)2NH•H2O] | |
| C. | D点溶液中:2c(Na+)=3c(Cl-) | |
| D. | 在相同温度下,A、B、C、D四点的溶液中,水的电离程度最大的是C点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
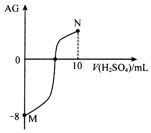 用AG表示溶液的酸度,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.298K时,c(OH-)在10.0mL 0.1mol•L-1氨水中滴入0.05mol•L-1硫酸溶液,溶液的酸度与所加硫酸溶液的体积关系如图所示.下列有关叙述正确的是( )
用AG表示溶液的酸度,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.298K时,c(OH-)在10.0mL 0.1mol•L-1氨水中滴入0.05mol•L-1硫酸溶液,溶液的酸度与所加硫酸溶液的体积关系如图所示.下列有关叙述正确的是( )| A. | 0.1 mol•L-1氨水的电离度约为1.0% | |
| B. | 滴定过程应该选择酚酞作为指示剂 | |
| C. | N点溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 滴定过程中从M点到N点溶液中水的电离程度先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
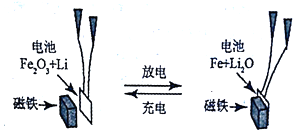
| A. | 该电池可以用NaOH溶液为电解质溶液 | |
| B. | 放电时电池正极的电极反应式为Fe2O3+6Li++6e-═3Li2O+2Fe | |
| C. | 充电时,Fe作为阴极,电池不被磁铁吸引 | |
| D. | 磁铁的主要成分是Fe3O4,其既可吸引铁,也可吸引Fe2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com