
����Ŀ��һ������CO2 ͨ�����Ϊ 50mL �� NaOH ��Һ�У�Ϊ�˲ⶨӦ����Һ�ijɷ֣������еμ� 1.0mol/L �����ᣬ������������������ CO2���������״���£��Ĺ�ϵ��ͼ��ʾ��

��1��OA �η�����Ӧ�����ӷ���ʽΪ��_______________________________��
��2����Һ�������ǣ�_____________�������ʵ���֮��Ϊ______________��
��3��ԭ NaOH ��Һ�����ʵ���Ũ��Ϊ_____________��
��4��ԭ NaOH ��Һ��ͨ�� CO2 �������_________mL��
��5������ NaOH ��Һ��ͨ������ CO2ʱ����Һ�е������� NaOH �� Na2CO3���������ʵ��֤�������ʵ���ɣ��벹��������
ʵ�鷽�� | ʵ������ | ʵ����� |
ȡ������Һ���Թ��У��������� BaCl2��Һ | ___________ | ˵����Һ�к��� Na2CO3 |
___________ | ___________ | ˵����Һ�к��� NaOH |
���𰸡� OH�� +H+=H2O��CO32��+H+=HCO3�� NaOH Na2CO3 n(NaOH)��n(Na2CO3)=1:6 1.3mol/L 672 �а�ɫ���� ȡ��Һ�������Թ��У������̪������MgCl2 ��CuCl2 �ȣ� ��Һ��죨�а�ɫ����ɫ�������ɵȣ�
����������1�����ͼ���֪����ʼû�ж�����̼�������ɣ�����OA��AB����������Ϊ̼���ƺ��������ƣ���OA���ȷ�������кͣ��ٷ���̼���������ᷴӦ����̼���������Ȼ��ƣ���Ӧ�����ӷ���ʽΪOH��+H+=H2O��CO32��+H+=HCO3������2�����ͼ���֪��������35mL����ʱ��ʼ��������������������ٷ����仯ʱ��������������65mL��35mL��30mL������̼���Ʒ�Ӧ����̼������ʱ������������Ҳ��30mL���������������Ʒ�Ӧ�����������5mL�����ݷ���ʽ��֪n(NaOH)��n(Na2CO3)=5:30=1:6����3����������ٷ����仯ʱ��Һ�е�����ǡ�����Ȼ��ƣ�������ԭ�Ӻ���ԭ���غ��֪�Ȼ�������ʵ��������������Ƶ����ʵ�����Ϊ0.065L��1mol/L��0.065mol�����������Ƶ�Ũ����0.065mol��0.05L��1.3mol/L����4��ԭNaOH��Һ��ͨ��CO2�����������AB�β��������������Ϊ0.03L��1mol/L��22.4L/mol��0.672L��672mL����5��̼���������Ȼ�����Һ��Ӧ���ɰ�ɫ��������ʵ���������а�ɫ��������������������ǿ���ʹ��̪��Һ���ɫ�����Լ����������ƵIJ�����ȡ��Һ�������Թ��У������̪��ʵ����������Һ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50 mL 18 mol��L��1��H2SO4��Һ�м���������ͭƬ�����ȡ���ַ�Ӧ����ԭ��H2SO4�����ʵ����� ��
A. ��0.45 mol B. ����0.45 mol
C. ��0.45��0.90 mol֮�� D. ����0.45 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ж�һ����Ӧ�Ƿ�Ϊ������ԭ��Ӧ�ı���(����)
A.�Ƿ�����Ԫ�زμӷ�Ӧ
B.�Ƿ�Ϊ�û���Ӧ
C.Ԫ�صĻ��ϼ��ڷ�Ӧǰ���Ƿ����仯
D.�Ƿ�Ϊ���Ϸ�Ӧ��ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����� 2 �� CH4 ���� x �����ӣ���ô 22 �� CO2 �������������ǣ� ��
A. x B. 4x C. 0.5x D. 3x
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�����õ������ H2 �� Cl2 ����ɵĻ����������Ӧֹͣ���ٻָ���ԭ�����¶Ⱥ�ѹǿ�� �����������뷢����Ӧǰǡ����ȣ������������������ǣ� ��
A. ��ԭ��������� H2 �� Cl2 ����������
B. ԭ��������� H2 �����һ������ Cl2 �����
C. ԭ��������� H2 �����һ��С�� Cl2 �����
D. ԭ��������� H2 �����ǡ���� Cl2 ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴ӦN2��g��+3H2��g��2NH3��g����H��0������ͼ����ȷ�� ��
A.
B.
C.
D.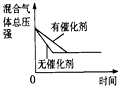
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ʵ�����ö������̸�Ũ���Ṳ�ȷ�Ӧ��ȡ��������ѧ����ʽ�� 4HCl��Ũ����MnO2![]() Cl2����MnCl2��2H2O��HCl ����������У�_____________________��
Cl2����MnCl2��2H2O��HCl �����������_____________________��
��2��KMnO4�dz��õ����������ø�����ظ�Ũ�������������������Ļ�ѧ����ʽ�ǣ�2 KMnO4 �� 16 HCl == 2KCl �� 2MnCl2 + 5Cl2�� + 8H2O ����˫���ŷ���ʾ�÷�Ӧ����ʽ�ĵ��ӵ�ʧ���_____________��
��3����ʷ���������ؿ���������������һ�������� CuCl2 ���������� 450�����ÿ����е��������Ȼ��ⷴӦ����������һ��Ӧ�Ļ�ѧ����ʽΪ_____________________��
��4����Ҫ�Ƶ� 71g �����������ַ����������� HCl ���ʵ���֮����_________�����뷴Ӧ�� HCl ����֮����_____________________��
��5���Ƚ�����������Ӧ��������������������ǿ������˳��Ϊ KMnO4>MnO2>O2������Ϊ�õ����˳��������ǣ�_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaOH����Һ�����ƺͱ궨���辭��NaOH��Һ���ơ�������H2C2O42H2O�ij����Լ���NaOH��Һ�ζ��Ȳ����������й�˵����ȷ���ǣ� ��
A.
��ͼ��ʾ����ת��NaOH��Һ������ƿ��
B.
��ͼ��ʾװ��ȷ�Ƶ�0.1575gH2C2O42H2O����
C. ��
��
ͼ��ʾ�����ų���ʽ�ζ����е�����
D.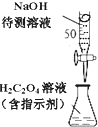
��ͼ��ʾװ����NaOH����Һ�ζ�H2C2O4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͬ���ʵ�����SO2��SO3,����˵����ȷ���� (����)
A. ��Ԫ�ص�������Ϊ5��4B. ������֮��Ϊ1��1
C. ԭ������֮��Ϊ4��3D. ����֮��Ϊ1��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com