
在一固定体积的密闭容器中,充入2 mol CO2和1 mol H2发生如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________________________________。
(2)若反应在830 ℃下达到平衡,则CO2气体的转化率为________。
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度______(填“升高”、“降低”或“不能确定”)。
(4)能判断该反应是否达到化学平衡状态的依据是______。
A.容器内压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
E.c(CO2 )·c(H2)=c(CO)·c(H2O)
答案 (1)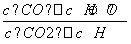 (2)33.3% (3)降低
(2)33.3% (3)降低
(4)BC
解析 (1)由K的定义,利用方程式可直接写出化学平衡常数的表达式为K=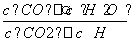 ;(2)利用“平衡三段式”法,结合化学平衡常数的表达式可以求出反应在830 ℃下达到平衡时CO2气体的物质的量,进而求出CO2气体的转化率为33.3%;(3)利用表中数据:升温,K值增大,说明反应是吸热反应,若在绝热条件下,平衡发生移动的结果是使容器内CO的浓度增大,则平衡正向移动,吸收热量,故容器内气体温度降低;(4)因该反应反应前后气体物质的量不变,故压强不能作为判断是否达到平衡状态的标志,由平衡状态特征及本质可知选项B、C可作为判断反应达到化学平衡状态的依据;选项D、E与平衡状态无直接关系。
;(2)利用“平衡三段式”法,结合化学平衡常数的表达式可以求出反应在830 ℃下达到平衡时CO2气体的物质的量,进而求出CO2气体的转化率为33.3%;(3)利用表中数据:升温,K值增大,说明反应是吸热反应,若在绝热条件下,平衡发生移动的结果是使容器内CO的浓度增大,则平衡正向移动,吸收热量,故容器内气体温度降低;(4)因该反应反应前后气体物质的量不变,故压强不能作为判断是否达到平衡状态的标志,由平衡状态特征及本质可知选项B、C可作为判断反应达到化学平衡状态的依据;选项D、E与平衡状态无直接关系。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A. 苏打溶液与稀盐酸反应的离子反应方程式:HCO3﹣+H+═CO2↑+H2O
B. Fe2O3与HI:Fe2O3+6H+═2Fe3++3H2O
C. NaHCO3溶液中滴加少量澄清石灰水:2HCO3﹣+Ca2++2OH﹣═CaCO3↓+2H2O+CO32﹣
D. 浓烧碱溶液中加入铝片:Al+OH﹣+H2O═AlO2﹣+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
在5L物质的量浓度为2mol/l的K2SO4溶液中K+的物质的量浓度为 ( )
A.2mol/l B.4mol/l C.1 mol/l D.20mol/l
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室配制500ml0.2m ol/L的Na2SO4溶液,实验操作有以下步骤:
ol/L的Na2SO4溶液,实验操作有以下步骤:
a.在托盘天平上称量出14g Na2SO4放于烧杯中加适量蒸馏水溶解并冷却至室温;
b.把制得的溶液小心转移至容量瓶中;
c.继续用烧杯向容量瓶中加水至凹液面与刻度线相切;
d.用少量蒸馏水洗涤烧杯和玻璃棒2-3次 ,并将洗涤液都小心注入容量瓶中,并轻轻振荡;
,并将洗涤液都小心注入容量瓶中,并轻轻振荡;
e.将容量瓶瓶塞塞紧,充分摇匀;
f.将所得溶液倒入指定试剂瓶中,贴好标签封存备用。
填写下列空白:
(1)操作步骤的正确顺序是 (填序号)。
(2)本实验用到的基本仪器已有托盘天平(带砝码)、镊子,
还缺少的仪器有 。
(3)上述步骤中有明显错误的是 (填序号)。
(4)下列情况会使所配制溶液浓度偏高的是 (填序号):
①定容时俯视;②定容时仰视;③没有进行上述操作步骤d;④加水时不慎超过了刻度线,发现后用胶头滴管吸出;⑤称量时用的砝码上沾有杂质;⑥容量瓶使用前没有干燥内壁附有水珠。
查看答案和解析>>
科目:高中化学 来源: 题型:
从植物花汁中提取的一种有机物,可简化表示为HIn,在水溶液中因存在下列平衡,故可用作酸、碱指示剂:
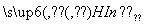 H+(溶液)+
H+(溶液)+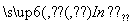
在上述溶液中加入下列物质,最终能使指示剂显黄色的是( )
A.盐酸 B.NaHCO3溶液
C.NaHSO4溶液 D.Na2O2(固体)
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温恒容的容器中进行反应 A(g)⇌2B(g)+C(g);△H>0,若反应物浓度由0.1mol•L﹣1降到0.06mol•L﹣1需20s,那么由0.06mol•L﹣1降到0.024mol•L﹣1,需反应的时间为( )
|
| A. | 等于18s | B. | 等于12s | C. | 大于18s | D. | 小于18s |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 |
|
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 |
|
| C. | 升高温度能使化学反应速率增大的主要原因是增加了反应物分子数 |
|
| D. | 催化剂能增大活化分子百分数,从而成千成万倍地增大化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将4mol A气体和2mol B气体在2L的密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g),反应2s后测得C的浓度为0.6mol/L.下列说法正确的是( )
A. 用物质A表示2 s内的平均反应速率为0.3 mol/(L•s)
B. 用物质B表示2 s内的平均反应速率为0.6 mol/(L•s)
C. 2 s后物质A的转化率为70%
D. 2 s后物质B的浓度为0.35 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化工生产过程中所发生的反应不属于氧化还原反应的是( )
|
| A. | 用氯气和消石灰制漂白粉 | B. | 用氢气和氮气合成氨 |
|
| C. | 用铝土矿冶炼金属铝 | D. | 用油脂制肥皂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com