

| A. | 容量瓶、分液漏斗和滴定管都需要验漏 | |
| B. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| C. | 用装置乙加热分解NaHCO3固体 | |
| D. | 配制500mL0.1mol•L?1NaCl溶液用到的玻璃仪器只有500mL容量瓶、烧杯和玻璃棒 |
分析 A.具有塞子、活塞的仪器需要检查漏液;
B.分液时,下层液体从下口漏出,上层液体从上口倒出;
C.加热固体应防止试管炸裂;
D.配制500mL0.1mol•L?1NaCl溶液的步骤有:计算、称量、溶解、转移、洗涤、定容、摇匀等,根据配制步骤选择使用的仪器.
解答 解:A.使用容量瓶、分液漏斗和滴定管时,首先要查仪器是否漏液,若漏液,仪器不能使用,故A正确;
B.分液时,为避免液体重新混合而污染,下层液体从下口漏出,上层液体从上口倒出,故B错误;
C.碳酸氢钠加热分解生成水,应防止试管炸裂,试管口应略朝下,故C错误;
D.配制500mL0.1mol•L?1NaCl溶液使用的仪器有:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故D错误;
故选A.
点评 本题考查混合物分离、提纯,溶液的配制,把握常见仪器的使用、实验基本操作等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 反应速率:两者相同 | B. | 消耗的n(HNO3):后者少 | ||
| C. | 气体颜色:前者浅 | D. | 转移电子总数:前者多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、S、Br2 | B. | CH4、SiH4、GeH4 | C. | Li、Na、K | D. | H2O、H2S、H2Se |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 条件 |
| A | K+、Na+、Cu2+、Cl- | 溶液呈无色 |
| B | Na+、Fe3+、NO3-、SO42- | 滴入酸性KMnO4溶液,溶液褪色 |
| C | Al3+、SO42-、Cl-、H+ | 加入氨水产生白色沉淀后沉淀溶解 |
| D | Na+、NO3-、I-、SO42- | 加入盐酸和淀粉溶液变蓝 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
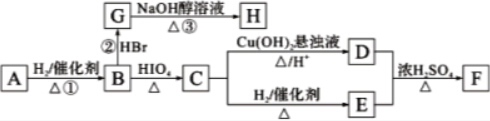
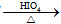 RCHO+R′CHO
RCHO+R′CHO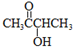 .
. CH3COO-+NH4++2Ag↓+3NH3+H2O.
CH3COO-+NH4++2Ag↓+3NH3+H2O. .若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为
.若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2可与HF反应,因而氢氟酸不能保存在玻璃瓶中 | |
| B. | SiO2可与水反应生成H2SiO3 | |
| C. | 向氯水中加CaCO3粉末,可提高溶液中HClO的浓度 | |
| D. | 向氯水中滴加蓝色石蕊试液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ |
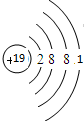 ,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示).
,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示). ,
,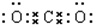 .
.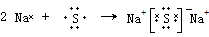 该化合物属于离子(填“共价”或“离子”)化合物.
该化合物属于离子(填“共价”或“离子”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
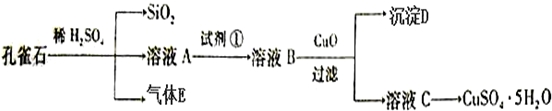
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图表示一个电解池,装有电解质溶液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解质溶液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com