
| A. | 电子数 | B. | 中子数 | C. | 质子数 | D. | 原子序数 |
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 铜片投入FeCl3溶液中:3Cu+2Fe3+═2Fe+3Cu2+ | |
| B. | AgCl悬浮液中加入Na2S溶液沉淀变黑:2AgCl+S2-═Ag2S+2Cl- | |
| C. | 用两根铁电极电解CuSO4溶液:2Cu 2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ | |
| D. | Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
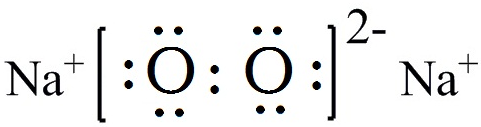 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可用于自来水的杀菌消毒 | B. | 氧化铁可用于红色油漆和涂料 | ||
| C. | 油脂可用于在碱性溶液制取肥皂 | D. | 含氮、磷的污水可用于给土壤施肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
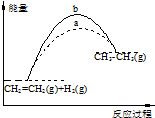
| A. | 图1中a、b曲线可分别表示反应CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时反应过程中的能量变化 | |
| B. | 己知2C(s)+2O2(g)═2CO2(g)△H1 ,2C(s)+O2(g)═2CO(g)△H2则△H1>△H2 | |
| C. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.4 kJ•mo1-1,20g氢氧化钠固体溶于稀盐酸中恰好完全反应时放出的热量等于28.7kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2S | B. | SO2 | C. | H2S | D. | SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属导电,属于电解质 | |
| B. | 乙酸是有机物,属于非电解质 | |
| C. | 只有在水溶液中能够导电的物质才属于电解质 | |
| D. | NaCl和Al2O3在熔融状态下均导电,都属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
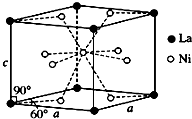 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com