
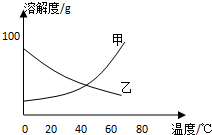
 甲、乙两种固体纯净物的溶解度曲线如图所示.在常温下,先在两支试管里分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里.下列说法正确的是( )
甲、乙两种固体纯净物的溶解度曲线如图所示.在常温下,先在两支试管里分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里.下列说法正确的是( )| A. | 乙溶液中溶质的质量分数增大 | B. | 装甲溶液的试管中剩余的固体减少 | ||
| C. | 试管里甲、乙物质的溶解度都增大 | D. | 两支试管里剩余的固体都增多 |
分析 常温下物质的饱和溶液(试管底部均有未溶解的固体)放进盛有冰水的烧杯里,操作的目的是对饱和溶液进行降温;根据溶解度曲线得知,甲物质的溶解度随温度降低而减小,乙物质的溶解度随温度降低而增大,据此分析解答.
解答 解:A.乙物质的溶解度随温度降低物质的溶解度变大,所以放入冰水后,随温度降低乙物质的溶解度变大,试管底部固体物质乙继续溶解,溶液中溶质质量增加,所以乙溶液中溶质的质量分数增大,故A正确;
B.甲物质的溶解度曲线表明,温度降低物质的溶解度减小,所以,放入冰水后,随温度降低甲物质的溶解度变小,试管内饱和溶液析出晶体,剩余固体物质甲增加,故B错误;
C.固体物质的溶解度受温度影响,根据溶解度曲线得知,甲物质的溶解度随温度降低而减小,乙物质的溶解度随温度降低而增大,故C错误;
D.综合A、B两项的分析可得,盛甲物质的试管内固体物质增加,而盛乙物质的试管内固体物质减少,故D错误.
故选A.
点评 本题考查固体溶解度曲线以及固体溶解度的影响因素,注意对相关概念的准确理解,难度中等.


科目:高中化学 来源: 题型:实验题
| 试管编号 | 实验现象 |
| A | 溶液不变色 |
| B | 溶液缓慢变浅棕褐色 |
| C | 溶液迅速变棕褐色 |

| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
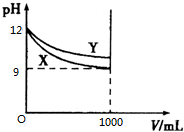 常温下pH=12的X、Y两种碱溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示.下列说法正确的是( )
常温下pH=12的X、Y两种碱溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示.下列说法正确的是( )| A. | X是弱碱,Y是强碱 | |
| B. | X、Y两种溶液稀释前溶质的物质的量浓度相等 | |
| C. | 两种溶液稀释后恢复至原温度,溶液中c(H+)与c(OH-)之比都变大 | |
| D. | 两种溶液稀释后恢复至原温度,溶液中c(H+)与c(OH-)的乘积都变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可以使湿润的红色布条褪色,所以氯气具有漂白性 | |
| B. | 在配制一定浓度的溶液时未冷却溶液直接将溶液转移至容量瓶中,则浓度偏高 | |
| C. | 因为KNO3的溶解度很大,所以可以用重结晶法除去KNO3中的NaCL杂质 | |
| D. | 向饱和FeCl3溶液中逐滴滴加沸水可以制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸和稀氨水反应 | B. | 稀硫酸和烧碱溶液反应 | ||
| C. | 稀硫酸和氢氧化铜反应 | D. | 稀硫酸和氢氧化钡溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
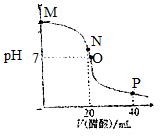 常温下,向20.0mL 0.10mol•L-1的NaOH溶液中逐滴加入0.10mol•L-1的醋酸溶液,溶液pH随醋酸溶液体积的变化如图所示.下列说法正确的是( )
常温下,向20.0mL 0.10mol•L-1的NaOH溶液中逐滴加入0.10mol•L-1的醋酸溶液,溶液pH随醋酸溶液体积的变化如图所示.下列说法正确的是( )| A. | N点处恰好完全反应,c(CH3COO-)=c(CH3COOH) | |
| B. | O点处显中性,c(CH3COO-)=c(Na+)=c(H+)=c(OH-) | |
| C. | M点到O点过程中,可能出现c(CH3COO-)>c(Na+) | |
| D. | P点处显酸性,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 精炼铜时,阳极有1mol物质放电,阴极一定生成NA个铜原子 | |
| B. | 在标准状况下,NA个SO3 分子的质量是80g,其体积就为80/ρ (ρ为SO3的密度) | |
| C. | 1molNaHSO4 熔融液中,其阴阳离子总数目为3NA | |
| D. | PH=1的盐酸溶液中,H+的数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com