
 甲醇与甲醚(CH3OCH3)都可作燃料电池的燃料.
甲醇与甲醚(CH3OCH3)都可作燃料电池的燃料.分析 (1)根据盖斯定律,用三个热化学方程式相互加减可得;
(2)①反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度、含量等不再发生变化,以及由此衍生的其它量不变,可由此进行判断.
②根据反应放热,故升高温度,平衡左移,据此判断CH3OCH3的产率;
(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,原电池反应比直接燃烧能量转化率高;
(4)惰性电极电解饱和食盐水,Y电极是阳极,溶液中氯离子失电子生成氯气;依据原电池和电解池中存在的电子守恒结合电极反应计算溶液中氢氧根离子浓度.
解答 解:(1)据盖斯定律
①CO2 (g)+3H2(g)?CH3OH (g)+H2O (1)△H=-akJ/mol;
②CH3OH (g)=CH3OH (1)△H=-bkJ/mol;
③2H2 (g)+O2(g)=2H2O (1)△H=-ckJ/mol
用反应③×$\frac{3}{2}$-(①+②)可得CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c-a-b)kJ•mol-1;
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c-a-b)kJ•mol-1;
(2)①A.在反应达平衡前,c(H2)与c(H2O)的比值在变小,故当c(H2)与c(H2O)的比值保持不变时,反应达平衡,故A选;
B.单位时间内有2mol H2消耗时一定会有1mol H2O生成,故不能作为平衡的标志,故B不选;
C.本反应的反应物和生成物全是气体,根据质量守恒可知,在反应过程中气体的质量一直不变,而又是恒容的容器,即气体体积不变,故气体密度ρ=$\frac{m}{V}$一直不变,故密度不变不能作为平衡的标志,故C不选;
D.此反应是个气体的物质的量有改变的反应,即在平衡之前,容器中气体的物质的量和压强在变化,故当压强不变时,说明反应达平衡,故D选.
故答案为:AD;
②反应放热,故升高温度,平衡左移,故CH3OCH3的产率将变小;故答案为:变小;
(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OCH3+16OH--12e-=2CO32-+11H2O,
故答案为:CH3OCH3+16OH--12e-=2CO32-+11H2O;
(4)电解池中Y电极为阳极,溶液中氯离子失电子发生氧化反应生成氯气,现象是冒气泡,上部溶液呈黄绿色;
当燃料电池消耗2.8LO2(标准状况下)物质的量=$\frac{2.8L}{22.4L/mol}$=0.125mol,电极反应为O2+2H2O+4e-=4OH-,电子转移为0.5mol,电解池中阴极电极反应为2H++2e-=H2↑,依据电子守恒溶液中增加氢氧根离子物质的量和减少的氢离子物质的量守恒,则溶液中氢氧根离子浓度=$\frac{0.5mol}{0.5L}$=1mol/L;
故答案为:Y电极附近溶液中有气体产生,上部分呈黄绿色;1.
点评 本题考查较为综合,涉及反应热与焓变、化学平衡状态的判断、原电池反应、电解池反应原理的应用判断,题目难度中等,明确化学平衡状态的特征为解答关键,注意掌握反应热与焓变的关系及应用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| 烯烃被氧化的部位 | CH2═ | RCH═ | 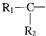 |
| 氧化产物 | CO2 | RCOOH | 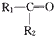 |
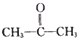 ),则该烯烃结构简式可能是( )
),则该烯烃结构简式可能是( )| A. | 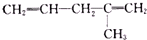 | B. | 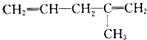 | ||
| C. | CH2=CH-CH=CHCH2CH3 | D. | 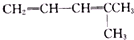 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
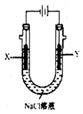
 某学生在课堂上学到了卤素、电解等化学知识后,想为自己家中制作一只简易的消毒液发生器.他用石墨(废干电池中的炭棒)作电极,饱和氯化钠溶液作为电解液,制成了如图所示的装置.通电数分钟后,果真制得了消毒液.他的实验居然一举获得成功!该装置中电源电极的名称和消毒液的主要成分正确的是( )
某学生在课堂上学到了卤素、电解等化学知识后,想为自己家中制作一只简易的消毒液发生器.他用石墨(废干电池中的炭棒)作电极,饱和氯化钠溶液作为电解液,制成了如图所示的装置.通电数分钟后,果真制得了消毒液.他的实验居然一举获得成功!该装置中电源电极的名称和消毒液的主要成分正确的是( )| A. | a为正极,b为负极;NaClO和NaCl | B. | a为负极,b为正极;NaClO和NaCl | ||
| C. | a为阳极,b为阴极;HClO和NaCl | D. | a为阴极,b为阳极;HClO和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
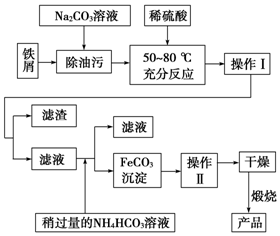 铁、铝和铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
铁、铝和铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向浸取液中加入BaCl2有白色沉淀,不能说明其中含有SO42- | |
| B. | 向浸取液中加入AgNO3溶液有白色沉淀,说明其中含有Cl- | |
| C. | 洁净铂丝蘸取浸取液少许,在酒精灯火焰上灼烧,火焰呈黄色,不能确定是否含K+ | |
| D. | 向浸取液中滴加稀硫酸,产生无色无味的气体,说明其中含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 气体A是SO2和CO2的混合气体 | |
| B. | 固体A一定含有SiO2,可能含有BaSO4 | |
| C. | 该固体混合物中Fe2O3和Fe至少有其中一种 | |
| D. | 该固体混合物一定含有Fe、Na2SO3、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 共价键 | 键能 | 共价键 | 键能 |
| H-H | 436 | H-F | 565 |
| C-F | 427 | H-S | 339 |
| C-C1 | 330 | H-Se | 314 |
| A. | H2(g)→2H(g)△H=+436kJ/mol | |
| B. | 键长越短,共价键越牢固 | |
| C. | 相同条件下CH3F比CH3C1更易发生水解反应 | |
| D. | 相同压强下,H2S的沸点比H2Se的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
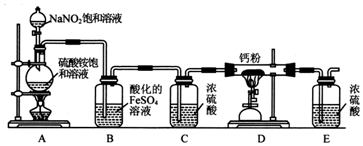
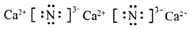 ;连接装置后,检查装置气密性的方法是检查装置气密性的方法是:关闭A中分液漏斗的活塞,向E中加入蒸馏水,微热A中的圆底烧瓶,E中有气泡冒出,冷却后,E中玻璃管形成一段水柱,则气密性良好.
;连接装置后,检查装置气密性的方法是检查装置气密性的方法是:关闭A中分液漏斗的活塞,向E中加入蒸馏水,微热A中的圆底烧瓶,E中有气泡冒出,冷却后,E中玻璃管形成一段水柱,则气密性良好.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
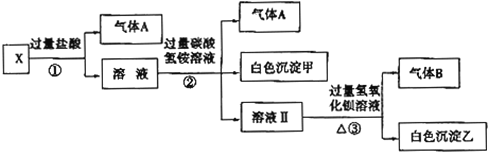
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com