
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
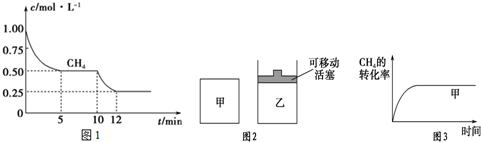
分析 (1)根据图可知,前5min内甲烷的浓度由1.00mol/L减小为0.50mol/L,以此计算v(H2),由图可知,10min时甲烷的浓度继续减小,该反应向正反应方向移动,化学平衡常数是各生成物浓度的化学计量数次幂的乘积与各反应物浓度的化学计量数次幂的乘积的比值;
(2)甲、乙两容器中分别充入等物质的量的CH4和CO2,且甲、乙两容器初始容积相等,由图可知,甲的体积不变,乙的压强不变,则假定甲不变,乙中发生CH4+CO2?2CO+2H2,其体积增大,则相当于压强减小,化学平衡向正反应方向移动,乙容器中CH4的转化率增大,但压强小,反应速率减慢,则达到平衡的时间变长;
(3)根据盖斯定律可知,①-②可得反应③,再利用Q与K的关系判断反应进行的方向,从而确定正逆反应速率的关系.
解答 解:(1)根据图可知,前5min内甲烷的浓度由1.00mol/L减小为0.50mol/L,则v(CH4)=$\frac{1.00mol/L-0.50mol/L}{5min}$=0.1mol/(L•min),由化学计量数之比等于反应速率之比,则v(H2)=3×0.1mol/(L•min)=0.3mol/(L•min),
由图可知,10min时甲烷的浓度继续减小,该反应向正反应方向移动,而该反应为吸热反应,则升高温度符合题意,
CH4(g)+H2O(g)?CO(g)+3H2(g),K=$\frac{c(CO)•c({H}_{2})^{3}}{c(C{H}_{4})•c({H}_{2}O)}$,
故答案为:0.3 mol/(L•min);升高温度;$\frac{c(CO)•c({H}_{2})^{3}}{c(C{H}_{4})•c({H}_{2}O)}$;
(2)甲、乙两容器中分别充入等物质的量的CH4和CO2,且甲、乙两容器初始容积相等,由图可知,甲的体积不变,乙的压强不变,则假定甲不变,乙中发生CH4+CO2?2CO+2H2,其体积增大,则相当于压强减小,化学平衡向正反应方向移动,乙容器中CH4的转化率增大,但压强小,反应速率减慢,则达到平衡的时间变长,则乙中CH4的转化率随时间变化的图象为 ,
,
故答案为: ;
;
(3)根据盖斯定律可知,①-②可得反应③,则△H3=+206.1kJ/mol-(+247.3kJ/mol)=-41.2kJ/mol,
800℃时,反应③的K=1.0时,正逆反应速率相等,化学平衡不移动;
由表格中的数据可知,气体的体积相同,则物质的量与浓度成正比,Q=$\frac{2.0×2.0}{0.5×8.5}$<K=1.0,该反应向正反应方向移动,则正反应速率大于逆反应速率,即选a,
故答案为:-41.2 kJ/mol;a.
点评 本题考查化学反应速率的计算,化学平衡的移动及反应方向的判断,难度中等,(2)是学生解答中的难点,注意利用思维转化的方法来解答.


科目:高中化学 来源: 题型:实验题
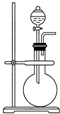 如图是实验室制取某些气体的装置.
如图是实验室制取某些气体的装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “爆竹声中除旧岁,春风送暖入屠苏”.爆竹爆将炸发生的是分解反应 | |
| B. | “甘之如饴”说明糖类均有甜味 | |
| C. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| D. | “火树银花”中的焰火实质上是金属元素的焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CO+3H2.
CO+3H2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 炼铁过程中的铁元素 | B. | 炼铁过程中的氧元素 | ||
| C. | 炼铁过程中的碳元素 | D. | 炼钢过程中的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
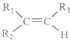 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$ +
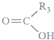
+
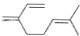 .
.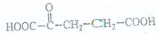
 )是月桂烯的一种同分异构体,其一氯代物有2种.
)是月桂烯的一种同分异构体,其一氯代物有2种.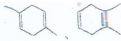 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝及其合金使用广泛,是因为铝比铁更耐酸、碱的腐蚀 | |
| B. | 通过红外光谱分析可以区分乙醇与乙酸乙酯 | |
| C. | 大部分金属的冶炼都是通过在高温下发生的氧化还原反应实现的 | |
| D. | 通常所说的三大合成材料是指塑料、合成橡胶和合成纤维 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com