
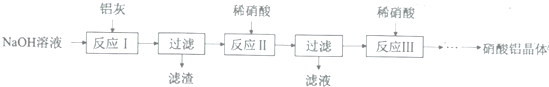
| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |
分析 铝灰用氢氧化钠溶液溶解,铝、氧化铝反应生成偏铝酸钠,氧化铁不反应,过滤分离,滤液中含有偏铝酸钠、未反应的NaOH,加入硝酸中和未反应的氢氧化钠,并将偏铝酸钠转化为氢氧化铝沉淀,再过滤分离,氢氧化铝沉淀再用硝酸溶解,得到硝酸铝溶液,经过减压蒸发得到硝酸铝晶体.
(1)用天平称量氢氧化钠,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌;
(2)硝酸属于强酸,可以溶解氢氧化铝沉淀,导致Al元素损失,应控制硝酸用量,可以利用弱酸将偏铝酸根转化为氢氧化铝沉淀而不溶解;
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干;
(4)产物中杂质NaNO3的含量较高;
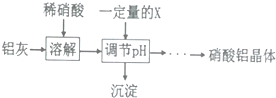
(5)铝灰用稀硝酸溶解,Al、A12O3、Fe2O3均反应得到硝酸铝、硝酸铁,加入X调节pH使铁离子转化为氢氧化铁沉淀,过滤除去,加入的X能与酸反应切不能引入新杂质;
(6)反应会生成NO,污染空气;
(7)硝酸铝晶体分解得到氧化铝、水,另外物质相当于N2O5,根据Al元素守恒计算硝酸铝的物质的量,
结合N原子守恒计算N2O5的质量,可得结晶水的质量,再计算结晶水的物质的量,进而计算结晶水数目.
解答 解:铝灰用氢氧化钠溶液溶解,铝、氧化铝反应生成偏铝酸钠,氧化铁不反应,过滤分离,滤液中含有偏铝酸钠、未反应的NaOH,加入硝酸中和未反应的氢氧化钠,并将偏铝酸钠转化为氢氧化铝沉淀,再过滤分离,氢氧化铝沉淀再用硝酸溶解,得到硝酸铝溶液,经过减压蒸发得到硝酸铝晶体.
(1)用天平称量氢氧化钠,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌,还需要量筒,
故答案为:b;
(2)硝酸属于强酸,可以溶解氢氧化铝沉淀,导致Al元素损失,需要解决的问题是:如何控制反应终点(或硝酸的用量),可以将加入稀硝酸改为通入过量CO2,避免氢氧化铝沉淀溶解,
故答案为:如何控制反应终点(或硝酸的用量);
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干,
故答案为:冷却结晶、洗涤;
(4)反应Ⅱ、Ⅲ合并以简化操作,产物中杂质NaNO3的含量较高,
故答案为:产物中杂质NaNO3的含量较高;
(5)铝灰用稀硝酸溶解,Al、A12O3、Fe2O3均反应得到硝酸铝、硝酸铁,加入X调节pH使铁离子转化为氢氧化铁沉淀,过滤除去,
加入的X能与酸反应切不能引入新杂质,故不能选氨水、偏铝酸钠,可以选择Al与氢氧化铝,
故答案为:将Fe3+转化为Fe(OH)3沉淀除去;BC;
(6)Al与稀硝酸反应会生成NO,污染空气,
故答案为:产生大量污染性气体NO等;
(7)硝酸铝晶体分解得到氧化铝、水,另外物质相当于N2O5,氧化铝的物质的量为$\frac{1.02g}{102g/mol}$=0.01mol,根据Al元素守恒,硝酸铝的物质的量为0.02mol,根据N原子守恒,可知N2O5为$\frac{0.02mol×3}{2}$=0.03mol,其质量为0.03mol×108g/mol=3.24g,故结晶水为质量为7.392g-1.02g-3.24g=3.132g,结晶水物质的量为$\frac{3.132g}{18g/mol}$=0.174mol,故结晶水数目为$\frac{0.174mol}{0.02mol}$=8.7,
故答案为:8.7.
点评 本题考查实验制备方案,侧重考查是对工艺流程的理解、分析与评价以及化学计算,是对学生综合能力的考查,需要学生具备知识的基础与灵活运用的能力,(7)中计算为易错点,学生不清楚发生的反应导致无法计算,难度中等.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
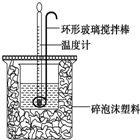 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Y>Z>W>R>X | |
| B. | 氢化物稳定性:X>W>R | |
| C. | Y、Z、W的最高价氧化物对应的水化物两两均可互相反应 | |
| D. | Y与Z不能存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
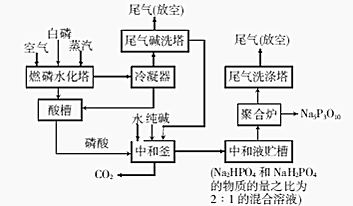
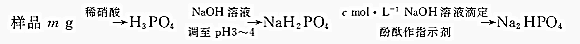
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
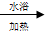 CH3CH2COONH4+3NH3+2Ag+H2O.在此过程中丙醛发生氧化(氧化、还原)反应,此反应可以检验醛基的存在.
CH3CH2COONH4+3NH3+2Ag+H2O.在此过程中丙醛发生氧化(氧化、还原)反应,此反应可以检验醛基的存在.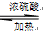 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.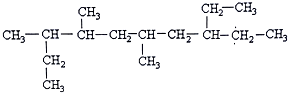
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com