
【题目】亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室利用下图装置制备亚硝酸钠,并测定所制亚硝酸钠的纯度。(加热装置及部分夹持装置已略去)
Ⅰ.亚硝酸钠的制备。
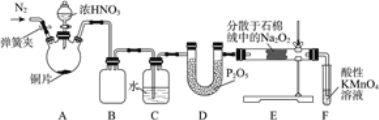
(1)盛放浓HNO3的仪器的名称为__________;装置B的作用是______________。
(2)装置E中制取NaNO2的化学方程式为___________________。
(3)多余的NO在装置F中被氧化为NO3-,反应的离子方程式为_____________。
(4)实验结束后打开A中弹簧夹,通入N2的目的是_______________。
Ⅱ.亚硝酸钠纯度的测定。
当Na2O2完全反应后,E中产生的固体除NaNO2外,还可能有NaNO3。测定亚硝酸钠纯度的步骤如下:
步骤一:取反应后的固体4.30 g溶于稀硫酸,向所得溶液中加入足量KI,将溶液中的NO2-和NO3-全部还原为NO,并通入足量N2,将NO全部赶出,最后将溶液稀释至1000 mL。
步骤二:取上述所得溶液10 mL,用淀粉作指示剂,用0.050 mol/L的Na2S2O3标准液滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,最终消耗Na2S2O3溶液体积为16.00 mL。
(5)步骤二中达到滴定终点的标志为______________________。
(6)混合固体中NaNO2的质量分数为________。(保留三位有效数字)
(7)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得亚硝酸钠的纯度________。(填“偏高”“偏低”或“无影响”)
【答案】分液漏斗 作安全瓶(防止液体倒吸) 2NO+Na2O2=2NaNO2 5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O 把装置内残留的NO驱赶至后续装置,使其充分吸收,避免污染空气 滴入最后一滴标准液后,溶液由蓝色褪为无色,且30 s内不再变化 80.2%(80.0%~80.3%即可) 偏低
【解析】
Cu与浓硝酸在装置A中反应产生NO2,随着反应的进行,当浓硝酸反应变为稀硝酸后,Cu与稀硝酸反应产生NO气体,装置B是安全瓶,气体经装置C,NO2会与水反应转化为HNO3和NO,NO气体经装置D中P2O5干燥后,在装置E中与Na2O2发生反应:2NO+Na2O2=2NaNO2,装置F是尾气处理装置,未反应的NO气体在装置F中被酸性高锰酸钾溶液氧化,防止污染环境。
(1)由装置图可知:盛放浓HNO3的仪器的名称为分液漏斗;装置B的作用是作安全瓶,防止液体倒吸。
(2)在装置E中NO与Na2O2发生反应NaNO2,反应的化学方程式为2NO+Na2O2=2NaNO2。
(3)装置F中多余的NO被酸性KMnO4氧化为NO3-,反应离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O。
(4)实验结束后,打开装置A中弹簧夹通入N2的目的是把装置内残留的NO驱赶至后续装置,使其充分吸收,避免污染空气。
(5)步骤二中以淀粉作指示剂,当达到滴定终点时,再滴入最后一滴标准液时,溶液由蓝色褪为无色,且30s内不再变化。
(6)步骤一将混合固体溶于稀硫酸,向所得溶液中加入足量KI,发生的反应方程式为4H++2NO2-+2I-=2NO↑+I2+2H2O和8H++2NO3-+6I-=2NO↑+3I2+4H2O,滴定过程发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,根据物料守恒,反应中Na2S2O3与I2的化学计量比为2∶1、I2与NO2-的化学计量比为1∶2、I2与NO3-反应的化学计量比为3∶2,则Na2S2O3与NO2-的化学计量比为1∶1、Na2S2O3与NO3-的化学计量比为3∶1,滴定消耗n(Na2S2O3)=0.050 mol·L-1×0.016 L=8.0×10-4 mol,设混合固体中NaNO2的质量分数为x,根据物料守恒得n(NaNO2)+3n(NaNO3)=n(Na2S2O3),则![]() mol=
mol=![]() ×8.0×10-4mol,解得x=0.802,所以混合固体中NaNO2的质量分数为80.2%(80.0%~80.3%即可)。
×8.0×10-4mol,解得x=0.802,所以混合固体中NaNO2的质量分数为80.2%(80.0%~80.3%即可)。
(7)若在滴定终点读取滴定管刻度时,仰视标准液液面,则滴定读数偏大,计算所得硝酸钠偏多,则测得亚硝酸钠的纯度偏低。


科目:高中化学 来源: 题型:
【题目】反应3A(g)+B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是
A.v(A)=1.5 mol·L-1·s-1
B.v(C)=0.5 mol·L-1·s-1
C.v(D)=0.6 mol·L-1·s-1
D.v(B)=0.4 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取1 mL 0.1 mol·L-1AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1 mol·L-1):

下列说法不正确的是
A.实验①白色沉淀是难溶的AgClB.若按②①顺序实验,能看到白色沉淀
C.若按①③顺序实验,能看到黑色沉淀D.由实验②说明 AgI 比 AgCl 更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiMn2O4是一种无污染、成本低的锂离子电池电极材料,某研究小组利用柠檬酸配合法制备LiMn2O4。
(1)按一定配比将醋酸锂(CH3COOLi)和醋酸锰[(CH3COO)2Mn]溶液混合后,加入柠檬酸(分子式C6H8O7)溶液中配成混料。用6 mol·L-1氨水调节pH至6.5~9,在75℃~85℃水浴中加热,制得柠檬酸配合物(其中Mn为+2价)。装置如图所示(加热和夹持装置已略去)。

①滴液漏斗中a管的作用是________。
②实验室用14.8 mol·L-1浓氨水配制250 mL 6mol·L-1的氨水需要的仪器有胶头滴管、烧杯、玻璃棒、量筒、________。
③调节pH至6.5~9是为了促进柠檬酸电离。pH不能大于9的原因是______。
④用水浴加热的目的是__________。
(2)将制得的配合物在烘箱中真空干燥得到固态柠檬酸配合物前驱体,研磨后焙烧,得LiMn2O4。
①柠檬酸配合物前驱体应放在_______(填仪器名称)中焙烧。
②焙烧需要在空气中进行的原因是__________。
③焙烧产生的气体是________。
(3)测定产品中锰的含量:准确称取0.1000 g的产品试样,加入足量浓盐酸溶液加热溶解,驱赶溶液中残留的Cl2,配成250 mL溶液。取25.00 mL溶液于锥形瓶中用0.02000 mol·L-1EDTA(Mn2+与EDTA按1:1络合)滴定,消耗EDTA溶液的体积V mL。样品中锰的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的方程式或离子方程式:
(1)工业制粗硅的反应方程式:___;
(2)铜与氯化铁溶液的离子方程式:___;
(3)氧化铁和氢碘酸溶液反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯是主要的化工产品。某课题组拟制备乙苯:查阅资料如下:
①几种有机物的沸点如下表:
有机物 | 苯 | 溴乙烷 | 乙苯 |
沸点/℃ | 80 | 38.4 | 136.2 |
②化学原理: ![]() +CH3CH2Br
+CH3CH2Br![]()
![]() +HBr。
+HBr。
③氯化铝易升华、易潮解。
I.制备氯化铝
甲同学选择下列装置制备氯化铝(装置不可重复使用):

(1)本实验制备氯气的发生装置的玻璃仪器有________种。
(2)连接装置之后,检查装置的气密性,装药品。先点燃A处酒精灯,当___________ 时(填实验现象)点燃F处酒精灯。
(3)气体流动方向是从左至右,装置导管接口连接顺序a→______→k→i→f→g→_____。
(4)D装置存在明显缺陷,若不改进,导致的实验后果是______________。
II.制备乙苯

乙同学设计实验步骤如下:
步骤1:连接装置并检查气密性(如图所示,夹持装置省略)。
步骤2:用酒精灯微热烧瓶。
步骤3:在烧瓶中加入少量无水氯化铝、适量的苯和溴乙烷。
步骤4:加热,充分反应半小时。
步骤5:提纯产品。
回答下列问题:
(5)本实验加热方式宜采用_______ (填“酒精灯直接加热”或“水浴加热”)。
(6)确认本实验A中已发生了反应的试剂可以是___。
A 硝酸银溶液 B 石蕊试液
C 品红溶液 D 氢氧化钠溶液
(7)提纯产品的操作步骤有:
①过滤; ②用稀盐酸洗涤; ③少量蒸馏水水洗 ④加入大量无水氯化钙;⑤用大量水洗; ⑥蒸馏并收集136.2℃馏分 ⑦分液。
操作的先后顺序为⑤⑦__ __⑦__ __⑥(填其它代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)-空气电池是目前储电能力最高的电池,示意图如图所示,该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5。下列说法错误的是
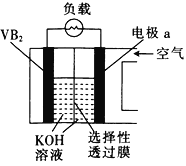
A. 电极a的电势比VB2极的高
B. VB2极的电极反应式为2VB2-22e-+22OH-=2B2O3+V2O5+11H2O
C. 放电时,OH-由VB2极向a电极移动
D. 若采用稀盐酸作电解质溶液,则该电池发生的总反应改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设有物质的量浓度为0.1mol/L和体积均相等的下列溶液:①H2CO3溶液 ②Na2CO3溶液 ③NaHCO3溶液 ④NH4HCO3溶液 ⑤(NH4)2CO3溶液。上列有关说法不正确的是
A.![]() 最大的是②
最大的是②
B.![]() 最大的是③
最大的是③
C.将溶液蒸干灼烧后只有①得不到对应的溶质
D.③④⑤既能与HCl反应,又能与NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-氨基-3-氯苯甲酸(F)是重要的医药中间体,其制备流程图如图:
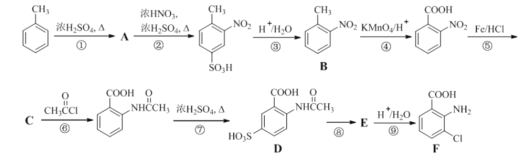
已知:![]()
![]()
![]()
回答下列问题:
(1)![]() 分子中不同化学环境的氢原子共有_______种,共面原子数目最多为_________。
分子中不同化学环境的氢原子共有_______种,共面原子数目最多为_________。
(2)写出⑧的反应试剂和条件______________;F中含氧官能团的名称为__________。
(3)该流程未采用甲苯直接硝化的方法制备B,而是经由①②③三步反应制取B,其目的是__________。
(4)写出⑥的化学反应方程式_______。
(5)B的名称为_________。写出符合下列条件B的所有同分异构体的结构简式________。
a.苯环上只有两个取代基且互为邻位
b.既能发生银镜反应又能发生水解反应
(6)请写出以 为主要原料,经最少步骤制备含酰胺键(结构与肽键相同)聚合物的流程_____。
为主要原料,经最少步骤制备含酰胺键(结构与肽键相同)聚合物的流程_____。 ……
……![]() 目标化合物
目标化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com