
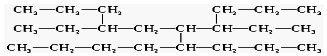
| A. | 8 | B. | 9 | C. | 11 | D. | 12 |
科目:高中化学 来源: 题型:解答题
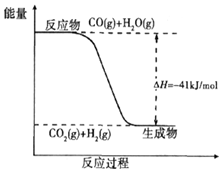 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C $\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2P2(g)═P4(g)△H=-229.7 kJ•mol-1 | B. | P2制P4是放热反应 | ||
| C. | P2比P4更加稳定 | D. | 等质量时,P2比P4具有的能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧菜用过的铁锅,经放置常出现红棕色斑迹 | |
| B. | 用煤气灶燃烧天然气为炒菜提供热量 | |
| C. | 牛奶久置空气中变质腐败 | |
| D. | 向沸水中滴入FeCl3饱和溶液,适当加热,制备胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
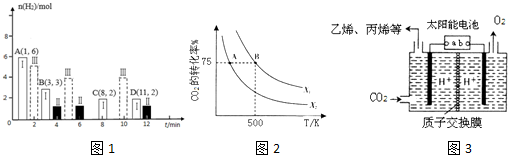
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| 投料比[n(NO2)/n(CH4)] | 400 K | 500 K | 600 K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
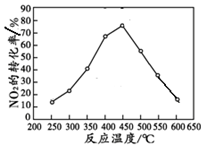
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为△H=-890kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890 kJ?mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知:H2(g)+F2(g)=2HF(g);△H=-270 kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 KJ | |
| D. | 在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2体积SO2和足量O2反应,一定不能生成2体积SO3 | |
| B. | 其他条件不变,增大压强,正反应速率增大逆反应速率也增大 | |
| C. | 加入2molSO2和1molO2放出的热量是加入1molSO2和0.5molO2放出热量的2倍 | |
| D. | 在该容器中先投入1molSO3,平衡后再加入1molSO3,达新平衡后SO2的体积分数比原平衡减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com