
【题目】TiO2在光照射下可使水分解H2和O2,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是( )
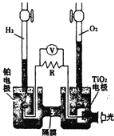
A.该装置可以将光能转化为电能,同时也能转化为化学能
B.铂电极上发生的反应为:H2-2e-=2H+
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:A 是石油裂解气的主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物 A~G 之间的转化关系:
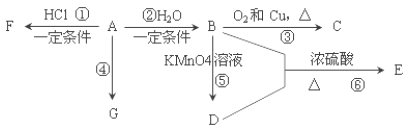
请回答下列问题:
(1)A 的官能团的名称是___________; C 的结构简式是________;
(2)E 是一种具有香味的液体, 由 B+D→E 的反应方程式为___________, 该反应类型是______________;
(3)G 是一种高分子化合物,其结构简式是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质 F(沸点 12.27°C)进行应急处理.写出由A 制 F 的化学反应方程式______________。
(5)E 的同分异构体能与 NaHCO3溶液反应,写出该同分异构体的结构简式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后测得c(D)=0.5mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
xC(g)+2D(g),5min后测得c(D)=0.5mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
(1)B的反应速率v(B)=_____X=___
(2)A在5min末的浓度是___
(3)此时容器内的压强与开始时之比为:____。
(4)二氯化硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。写出它的电子式______;
(5)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___。Se2Cl2常用作分析试剂,其结构式为___。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是___(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I某钙钛矿型太阳能电池吸光材料的晶胞结构如图所示,其中A通常为CH3NH3+,可由甲胺(CH3NH2)制得;M为Pb2+或Sn2+;X为卤离子,如Cl-、Br-等。
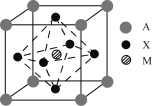
(1)吸光材料的化学式为___(用A、X、M表示)。
(2)H、C、Cl三种元素的电负性由小到大的顺序为____。
(3)溴原子基态核外价电子排布式为___。
(4)甲胺(CH3NH2)极易溶于水,除因为它们都是极性分子外,还因为___。
(5)CH3NH2中N原子的轨道杂化类型为__;1mol CH3NH3+中含σ键的数目为____。
II 镍的单质、合金及其化合物用途非常广泛。
(1)Ni在周期表中的位置为___。
(2)[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4的熔沸点比C2H6高的多的原因是____;[Ni(N2H4)2]2+中含四个配位键,不考虑空间构型,[Ni(N2H4)2]2+的结构可用示意图表示为_____。
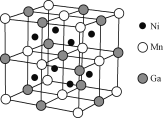
(3)一种新型的功能材料的晶胞结构如图所示,它的化学式可表示为___。每个Mn周围最近且等距离的Mn数目为___,每个Ga周围最近且等距离的Mn数目为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体中不可缺少的元素,为了预防碘缺乏,通常在精盐中添加一定的KIO3。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关资料,发现其检测原理是:KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
(1)用双线桥表示该反应中电子转移的方向和数目___________________________________,该反应中还原产物与氧化产物的质量之比是__________,0.2mol KIO3参加反应时,转移的电子为________mol。
(2)上面实验中用到一定物质的量浓度的稀硫酸,若配制1.0 mol/L的稀硫酸500mL,配制中需要用到的主要玻璃仪器有___________(填选项),需用18.0mol/L 浓硫酸_________mL。
a.100mL量筒 b.玻璃棒 c.100mL容量瓶 d.50mL量筒 e.胶头滴管
f.烧杯 g.500mL容量瓶
(3)下面操作造成所配稀硫酸溶液浓度偏高的有____________(填选项)。
a.溶解后溶液没有冷却到室温就转移;b.转移时没有洗涤烧杯、玻璃棒;c.转移过程中有少量液体流出;d.向容量瓶加水定容时眼睛俯视液面;e.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl-、Br-、CrO42-B. Br-、Cl-、CrO42-
C. CrO42-、Br-、Cl-D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积固定的密闭容器中,发生可逆反应A(g)+2B(g)![]() 2C(g),平衡时,各物质的浓度比为c(A):c(B):c(C)=1:1:2保持温度不变,以1:1:2的体积比再充入A、B、C,则下列叙述正确的是( )
2C(g),平衡时,各物质的浓度比为c(A):c(B):c(C)=1:1:2保持温度不变,以1:1:2的体积比再充入A、B、C,则下列叙述正确的是( )
A.刚充人时反应速率:v(正)减小,v(逆)增大
B.达到新的平衡时:反应混合物中A.B的物质的量分数不变
C.达到新的平衡时:c(A):c(B):c(C)仍为1:1:2
D.达到新的平衡过程中:体系压强先增大,后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 9 B. 16 C. 20 D. 25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.碘酸钾(KIO3)是一种白色或无色固体,可溶于水,具有较强的氧化性。常添加于食盐中用以防治碘缺乏病。已知在某反应体系中存在以下几个物质: KIO3、K2SO4、KI、I2、H2SO4、H2O。
(1)书写并配平该反应方程式,并标出电子转移的方向和数目:_________________;
(2)下列说法中正确的是_________。
A.I2是非电解质 B.K2SO4溶液的导电能力一定比KI溶液的强
C.H2SO4没有参加氧化还原反应 D.氧化产物和还原产物都是I2
Ⅱ.二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用,实验室可用KClO3通过以下反应制得:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O
试回答下列问题。
(3)该反应中还原产物的化学式是_________;被氧化的元素是_________。
(4)生成标况下4.48LCO2,电子转移数是_______________。
(5)ClO2和Cl2均能将电镀废水中的CN 反应为无毒的物质,自身反应后均生成Cl,此过程说明ClO2和Cl2均具有_________ (填“氧化”或“还原”)性。处理含相同量CN的电镀废水,所需Cl2的物质的量是ClO2的_________倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com