
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,冷却水应从冷凝器下端进入 |
| C、蒸发时,要用玻璃棒不断搅动溶液 |
| D、过滤时,将待过滤的液体直接倒入漏斗,使液面低于滤纸的边缘 |


科目:高中化学 来源: 题型:
 现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知2H2(g+O2(g)=2H2O(g)△H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol |
| B、稀氢氧化钠溶液与稀盐酸溶液中和,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol |
| C、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D、需要加热才能发生的反应不一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:3 | B、3:1 |
| C、1:2 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.784 | B、0.896 |
| C、1.00 | D、1.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
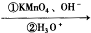 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH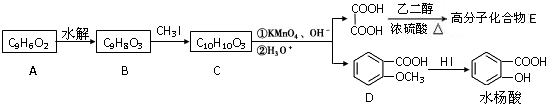
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1NH4Cl溶液:c(NH4+)=c(Cl-) |
| B、在25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7 |
| C、0.1 mol?L-1与0.2 mol?L-1氨水溶液中c(OH-)之比为1:2 |
| D、中和pH与体积都相同的氨水和Ba(OH)2溶液,消耗HCl的物质的量之比是1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com