
(12分)某工业废水肿含有一定量的Cr2O72-和CrO42-,现
取样该工业废水,检测其中铬的含量。
步骤I:取25. 00 mL废水,加入适后稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,滴人几滴指示剂。
步骤Ⅲ: 用o .1000 mol·L-1Na2S2O3溶液滴定(I2+2Na2 S2O3= 2NaI+Na2S4O6)
达到终点时消耗溶液24. 00 mL。
步骤Ⅳ:将上述反应后的溶液进行如下处理:反应后废液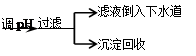
回答下列问题
(1)步骤I加入稀硫酸酸化的目的是 ;
(2)步骤Ⅱ中发生如下反应,请完善并配平离子方程式
该步骤中所加指示剂是 ;
(3)步骤Ⅲ判断滴定达到终点的现象是__ __。
(4)步骤Ⅳ在生产生活中的意义是____ (任答一条);
(5)计算工业废水中铬元素的含量是 mg/L.
(1)使CrO42-尽可能转化为Cr2O72-,为步骤II提供酸性环境
(2)1、6、14H+ 、2 、 3、7 淀粉溶液
(3)溶液深蓝色褪去
(4)防止重金属(Cr)污染(或资源回收利用)
(5)1664
解析试题分析:(1)因为Cr2O72-和CrO42-之间存在平衡2 CrO42-(黄色)+H+═7Cr2O72-(橙色)+H2O,加酸的目的是使CrO42-尽可能转化为Cr2O72-,为步骤II提供酸性环境;
(2)产物中有水生成,所以反应物中有H+存在,根据得失电子守恒,反应物Cr2O72-中Cr的化合价是+6,产物中Cr的化合价是+3,降低6价;反应物中I-的化合价是-1,生成物中I2的化合价是0,升高2价,所以I2的系数是3,I-的系数是6,Cr2O72-的系数是1,Cr3+的系数是2,再根据电荷守恒配平氢离子的系数是14,最后根据元素守恒配平H2O的系数是7;该反应有碘生成,所以用淀粉溶液作指示剂,溶液变蓝色;
(3)步骤Ⅲ是用Na2S2O3溶液滴定I2,碘反应完全后,溶液为无色,所以判断滴定达到终点的现象是溶液深蓝色褪去且半分钟内不恢复;
(4)反应后的废液中含有Cr3+,属于重金属,所以步骤Ⅳ在生产生活中的意义是防止重金属(Cr)污染(或资源回收利用);
(5)根据所给化学方程式与所配方程式可知2 Cr3+~3I2~6Na2 S2O3,所以工业废水中铬元素的质量是24mL×o .1000 mol·L-1×1/3×52g/mol=41.6mg,则工业废水中铬元素的含量是41.6mg/0.025L=1664mg/L。
考点:考查定量实验的分析与计算


科目:高中化学 来源: 题型:单选题
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐Q。下列有关说法错误的是
| A.该反应的化学方程式为:4NH3 + 3F2 → NF3 + 3NH4F |
| B.M是极性分子,其还原性比NH3强 |
| C.M既是氧化产物,又是还原产物 |
| D.4moNH3参加反应失去12mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氧化还原反应是重要的反应类型,下列有关说法正确的是
| A.1molAl和足量的NaOH溶液反应,失去的电子数为3NA(NA表示阿伏加德罗常数) |
| B.原电池的负极发生氧化反应,电解池的阳极发生还原反应 |
| C.Cu能被FeCl3溶液腐蚀,其离子方程式为:Cu+Fe3+=Cu2++Fe2+ |
| D.Na+、Ba2+、NO3-、SO32-四种离子在溶液中因发生氧化还原反应而不能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
RO2受热分解为+4和+2价的混合氧化物,+4价的R能氧化浓盐酸生成Cl2,现将1mol RO2加热分解得到O2,再向残余固体中加入过量的浓盐酸得到Cl2,所得 O2和Cl2物质的量之比为3 : 2,则残余固体的组成及物质的量之比可能是
| A.R3O4,RO,2 :1 | B.RO2,RO, 1:3 |
| C.RO2,R3O4 ,1 : 2 | D.RO2,RO,1 : 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为2:1时,实际参加反应的Cu2S与HNO3的物质的量之比为
| A.1:10 | B.1:8 | C.1:6 | D.1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12 分)(原创)部分弱酸的电离平衡常数如表:
| 弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
| 电离平衡常数 (25℃) | K=1.8×10﹣4 | K=5.1×10﹣4 | K1=9.1×10﹣8 K2=1.1×10﹣12 | K1=1.23×10﹣2 K2=6.6×10﹣8 | K1=5.4×10﹣2 K2=5.4×10﹣5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)无论是从在国民经济中的地位来看,还是从科学发展的角度来看,硅都发挥着重要的作用。
(1)人类使用硅酸盐产品(陶瓷等)的历史已经快一万年了,但在1823年才获得单质硅,瑞典化学家贝采尼乌斯用金属钾还原SiF4获得单质硅,写出化学方程式_______________ 。
(2)由于制取方法和条件的不同,得到的单质硅形态不同,其性质也不同。
①用铝热法还原氟硅酸钾制得较纯净的晶体硅:4Al+3K2SiF6高温3Si+2KAlF4+2K2AlF5,关于该反应的说法正确的是________(填序号)。
| A.Al是还原剂 | B.氧化产物只有KAlF4 |
| C.每转移6NA电子,得到42 g Si | D.Al元素在KAlF4和K2AlF5中化合价不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。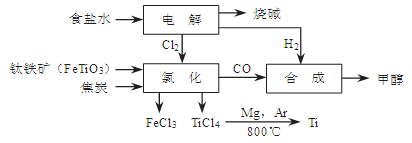
请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式: 。
(2)由CO和H2合成甲醇是放热的,方程式是:CO(g)+2H2(g)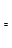 CH3OH(g)。
CH3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②下图表示合成甲醇反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的甲醇的含量最高的一段时间是 。图中t3时改变的条件可能是 。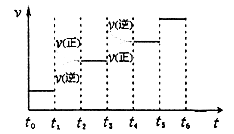
(3)某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图: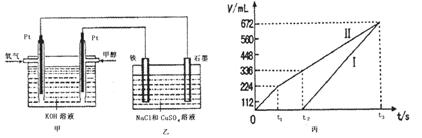
①写出甲中通入甲醇这一极的电极反应式 。
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ,原混合溶液中NaCl的物质的量浓度为 mol/L。(假设溶液体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
⑴人们常用催化剂来选择反应进行的方向。如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。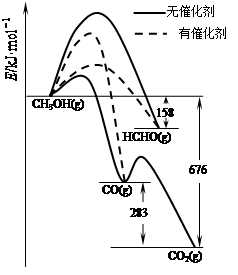
①在有催化剂作用下,CH3OH与O2反应主要生成 (填“CO、CO2或HCHO”)。
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H= 。
③在稀硫酸催化下,HCHO可以通过反应生成分子式为C3H6O3的环状三聚甲醛分子,其分子中同种原子的化学环境均相同。写出三聚甲醛的结构简式: 。
④甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性,用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
⑵一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O="2n" CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为 g。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com