
| A. | 保存FeCl3溶液时,可加入少量NaOH,抑制Fe3+水解 | |
| B. | 1molMg在空气中完全燃烧生成MgO和少量Mg3N2,转移的电子数为2NA | |
| C. | 加入铝粉能产生H2的溶液中可以大量存在Fe2+、Na+、SO42-、ClO-四种离子 | |
| D. | 向硫酸氢铵溶液中滴加少量NaOH溶液时发生反应的离子方程式:H++NH4++20H-═NH3•HzO+H2O |
分析 A.氯化铁溶液中氯化铁水解生成氢氧化铁和盐酸,溶液显酸性,加入氢氧化钠会促进水解;
B.1mol镁原子最外层2mol电子,完全反应失去电子2mol;
C.加入铝粉能产生H2的溶液可能是酸溶液,也可以是碱溶液;
D.向硫酸氢铵溶液中滴加少量NaOH溶液,氢氧根离子只和氢离子发生反应.
解答 解:A.氯化铁溶液中氯化铁水解生成氢氧化铁和盐酸,溶液显酸性,FeCl3+3H2O?Fe(OH)3+3HCl,加入氢氧化钠和盐酸反应会促进水解,应加入盐酸抑制水解,故A错误;
B.1mol镁原子最外层2mol电子,完全反应失去电子2mol,1molMg在空气中完全燃烧生成MgO和少量Mg3N2,都是Mg~Mg2+,转移的电子数为2NA,故B正确;
C.加入铝粉能产生H2的溶液可能是酸溶液,也可以是碱溶液,酸溶液中ClO-具有氧化性能氧化亚铁离子生成铁离子不能大量存在,碱性溶液中亚铁离子不能大量存在,故C错误;
D.向硫酸氢铵溶液中滴加少量NaOH溶液,氢氧根离子只和氢离子发生反应,离子方程式为:H++0H-═H2O,故D错误;
故选B.
点评 本题考查了盐类水解的原理、离子共存的分析判断、离子方程式书写方法等知识点,掌握基础是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 工业上冶炼活泼金属的单质都是通过电解法 | |
| B. | 工业上冶炼粗硅是用热还原法 | |
| C. | 消耗等质量的氢气,碱性氢氧电池放电量大于酸性介质的放电量 | |
| D. | 硫酸工业的尾气可以用氨水吸收并制得铵盐 |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
下列物质的转化在给定条件下能实现的是
A.Fe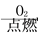 Fe2O3
Fe2O3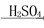 Fe2(SO4)3
Fe2(SO4)3
B.MgO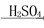 MgSO4(aq)
MgSO4(aq)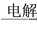 Mg
Mg
C.饱和NaCl(aq)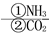 NaHCO3
NaHCO3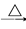 Na2CO3
Na2CO3
D.NH3 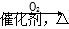 NO
NO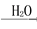 HNO3
HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温常压下是气体.原子的M层上有1个未成对的p电子. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向苯酚钠溶液中通入少量的SO2气体:C6H5O-+SO2+H2O→C6H5OH+HSO3- | |
| B. | 次氯酸钙溶液中通入过量二氧化碳:ClO-+H2O+CO2═HCO3-+HClO | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2至溶液恰好呈现中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | Fe3+Br2 | Cl- | |
| ② | KClO3 | 浓盐酸 | Cl2 | ||
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中①组的反应可能有一种或两种元素被氧化 | |
| B. | 氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |
| C. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| D. | 表中③组反应的离子方程式为:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯可以燃烧 | |
| C. | 苯能使酸性高锰酸钾溶液褪色 | |
| D. | 苯通常易发生取代反应较难发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,1mol氦气含有的原子数为NA | |
| B. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| C. | 常温常压下,氧气和臭氧(O3)的混合物32g中含有NA个氧原子 | |
| D. | 物质的量浓度为1 mol•L-1的K2SO4溶液中,含2NA个K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com