
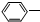
 )
)
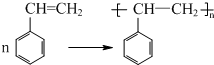 (不要求写出反应条件)
(不要求写出反应条件)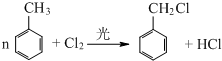 (要求写出反应条件)
(要求写出反应条件)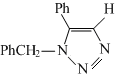 .
.分析 反应①是PhCH2CH3中亚甲基中-H被-Cl所取代,属于取代反应,PhCHClCH3在氢氧化钠水溶液、加热条件下发生水解反应得到PhCH(OH)CH3,由反应②产物结构可知,PhCH(OH)CH3在浓硫酸、加热条件下发生消去反应生成Ⅱ为PhCH=CH2,反应②为PhCH=CH2与溴发生加成反应,PhCHBrCH2Br在氢氧化钠醇溶液、加热条件下发生消去反应得到PhC≡CH.根据PhCH2Cl,可推知Ⅳ为PhCH3,反应④为PhCH2Cl中-Cl为-N3取代,PhC≡CH与PhCH2N3发生环加成反应成化合物V,据此答题.
解答 解:反应①是PhCH2CH3中亚甲基中-H被-Cl所取代,属于取代反应,PhCHClCH3在氢氧化钠水溶液、加热条件下发生水解反应得到PhCH(OH)CH3,由反应②产物结构可知,PhCH(OH)CH3在浓硫酸、加热条件下发生消去反应生成Ⅱ为PhCH=CH2,反应②为PhCH=CH2与溴发生加成反应,PhCHBrCH2Br在氢氧化钠醇溶液、加热条件下发生消去反应得到PhC≡CH.根据PhCH2Cl,可推知Ⅳ为PhCH3,反应④为PhCH2Cl中-Cl为-N3取代,PhC≡CH与PhCH2N3发生环加成反应成化合物V,
(1)A.反应①是PhCH2CH3中亚甲基中-H被-Cl所取代,属于取代反应,反应④为: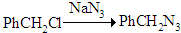 ,可以看作是-Cl被-N3所取代,为取代反应,故A正确;
,可以看作是-Cl被-N3所取代,为取代反应,故A正确;
B.化合物Ⅰ含有羟基,为醇类物质,羟基相连的碳原子上存在一个氢原子,故可以发生氧化反应,故B错误;
C.Ⅱ为PhCH=CH2,在一定条件下与水发生加成反应,可能会生产化合物Ⅰ,故C正确;
D.化合物Ⅱ为PhCH=CH2,能与氢气发生加成反应,与反应②(反应②是烯烃与溴加成)的相同,故D正确,
故答案为:B;
(2)PhCH=CH2中含有C=C,可发生加聚反应,反应方程式为: ,
,
故答案为: ;
;
(3)反应③是光照条件下进行的,发生的是取代反应,反应方程式为: ,
,
故答案为: ;
;
(4)化合物Ⅲ与PhCH2N3发生环加成反应生成化合物V的分子式为C15H13N3,不同条件下环加成反应还可以生成化合物V的同分异构体,结合Ⅴ的结构可知,该同分异构体为 ,
,
故答案为:C15H13N3; .
.
(5)合成C(N3)4的反应可能为:4NaN3+NC-CCl3→C(N3)4+NaCN+3NaCl,属于取代反应,故A正确;
B.C(N3)4相当于甲烷(CH4)分子中的四个氢原子被-N3所取代,故它的空间结构与甲烷类似,故B正确;
C.该分子存在与PhCH2N3相同的基团-N3,故该化合物可能发生加成反应,故C错误;
D.根据题意其可分解成单质,C(N3)4可分解成单质,故D正确.
故答案为:ABD.
点评 本题考查有机物合成、常见有机物的结构与性质,题目难度中等,注意根据有机物的结构进行分析解答,需要学生熟练掌握官能团的性质与转化,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | C4H8O2属于酯的同分异构体 | B. | C5H10O2属于酸的同分异构体 | ||
| C. | 甲苯的一氯取代物 | D. | 化合物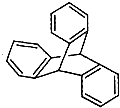 的一氯取代物 的一氯取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 1:2 | C. | 3:1 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(Ba2+)=C(SO42-)=Ksp½ | |
| B. | C(Ba2+)•C(SO42-)>Ksp C(Ba2+)=C(SO42-) | |
| C. | C(Ba2+)•C(SO42-)=Ksp C(Ba2+)>C(SO42-) | |
| D. | C(Ba2+)•C(SO42-)≠Ksp C(Ba2+)<C C(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com