
| Kw |
| c(H+) |
| Kw |
| c(H+) |
| 10-14 |
| 10-3 |
| 10-11 |
| 10-3 |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
| A组 | B组 | C组 | D组 |
| 硅晶体:1 415℃ | Li:181℃ | HCl:-115℃ | KCl:776℃ |
| 硼晶体:2 300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 氮化硼:3 000℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

 制成,合成路线如下:
制成,合成路线如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n:( n+2 ) |
| B、1:1 |
| C、1:( n+2 ) |
| D、(n+2):n |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ag | ||
| B、2ag | ||
C、
| ||
| D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
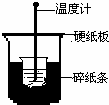 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com