
【题目】某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如表:
实验序号 | A 溶液 | B 溶液 |
① | 20 mL 0.1 molL﹣1 H2C2O4 溶液 | 30 mL 0.01 molL﹣1KMnO4 酸性溶液 |
② | 20 mL 0.2 molL﹣1 H2C2O4 溶液 | 30 mL 0.01 molL﹣1 KMnO4酸性溶液 |

(1)检验如图装置气密性的最简便方法为: .
(2)H2C2O溶液与酸性 KMnO4溶液反应的化学方程式为 .
(3)该实验探究的是因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是(填实验序号).
(4)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)=(若忽略溶液混合前后体积的变化).
(5)小组同学发现反应速率总是如图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①、②、③K+对该反应有催化作用.
【答案】
(1)先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性良好
(2)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(3)浓度;②>①
(4)0.0052mol/L
(5)该反应为放热反应;产物Mn2+是反应的催化剂
【解析】解:(1)检验装置气密性的简便方法为先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性良好,故答案为:先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性良好;(2)KMnO4和H2C2O4发生氧化还原反应生成锰离子、二氧化碳、水,KMnO4和中锰降低了5价,1个H2C2O4分子中有2个+3价的C,所以升高1×2=2价,根据化合价升降总数相等可以确定KMnO4和H2C2O4比例关系为2:5,根据电荷守恒配平方程式:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,
故答案为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O;(3)对比①②实验可探究草酸的浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,相同时间所得CO2的体积大,
故答案为:浓度;②>①;(4)CO2的物质的量为: ![]() =0.0002mol,设2min末,反应消耗的n(MnO4﹣)为x,
=0.0002mol,设2min末,反应消耗的n(MnO4﹣)为x,
2MnO4﹣+ | 5H2C2O4+ | 6H+ | = | 2Mn2++ | 10CO2↑+ | 8H2O |
2 | 10 | |||||
x | 0.0002mol |
解得 x=0.00004mol
反应剩余的高锰酸根离子的物质的量为:30×10﹣3L×0.01molL﹣1﹣0.00004mol=0.00026mol
c(MnO4﹣)= ![]() =
= ![]() =0.0052mol/L;
=0.0052mol/L;
故答案为:0.0052;(5)研究发现反应速率总是如图2所示发生变化,则t1~t2时间内速率变快的主要原因可能是:
①该反应为放热反应,反应放出的热量使环境温度升高,加快了反应速率,
②产物Mn2+是反应的催化剂,
故答案为:该反应放热;产物Mn2+是反应的催化剂.
(1)关闭分液漏斗的活塞,拉动活塞,松手后观察活塞是否复原可检查气密性;(2)KMnO4和H2C2O4发生氧化还原反应生成锰离子、二氧化碳、水,根据得失电子守恒、电荷守恒配平方程式;(3)对比①②实验可探究草酸浓度对化学反应速率的影响,②中A溶液的浓度比①中大;(4)先求出反应的n(MnO4﹣)的物质的量,再求出反应后的浓度;(5)根据反应过程中反应物浓度在减小,要加快反应的条件还可能是温度和催化剂的作用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定量的氢气在一定条件下完全燃烧生成气态水,放出热量值为Q1,等量的H2在同样条件下完全燃烧生成液态水,放出热量值为Q2,则Q1与Q2的关系为
A. Q1>Q2B. Q1=Q2C. Q1<Q2D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
B. 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
C. 废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源
D. 凡含有食品添加剂的食物对人体健康均有害,不宜食用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际化学年的中国宣传口号是“化学-----我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”道理。请填空:
(1)①若金属钠等活泼金属着火时,应该_______________用来灭火。
②经火焰灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)的元素是。_______________
③胃舒平(含有氢氧化铝)可治疗胃酸过多,其反应的离子反应方程式为:_______________。
④明矾能净水,其电离方程式是_______________。
(2)过氧化钠作潜艇供氧剂时发生的化学反应方程式是_____________。
(3)加热Al片的实验现象是_________________,原因是_____________。
【答案】 干沙子 K Al(OH)3 + 3H+ =Al3+ + 3H2O KAl(SO4)2 =K++ Al3+ + 2SO42- 2Na2O2 + 2CO2![]() 2Na2CO3+ O2 铝片融化,但是不脱落 氧化铝熔点高于铝,包在铝的外面。
2Na2CO3+ O2 铝片融化,但是不脱落 氧化铝熔点高于铝,包在铝的外面。
【解析】(1)①钠着火生成过氧化钠,可与二氧化碳或水反应生成氧气,且钠与水反应生成氢气,若金属钠等活泼金属着火时,应该用干沙子灭火;②含K元素的物质焰色反应为浅紫色(透过蓝色钴玻璃);③氢氧化铝治疗胃酸(盐酸)过多的离子反应方程式为:Al(OH)3+3H+=Al3++3H2O;④明矾是KAl(SO4)212H2O,溶于水后得KAl(SO4)2溶液,在溶液中能完全电离为铝离子、钾离子和硫酸根,故电离方程式为:KAl(SO4)2═K++Al3++2SO42﹣;(2)过氧化钠作潜艇供氧剂时发生的化学反应方程式是2Na2O2 + 2CO2![]() 2Na2CO3+ O2;(3)加热Al片的实验现象是铝片融化,但是不脱落,原因是氧化铝熔点高于铝,包在铝的外面。
2Na2CO3+ O2;(3)加热Al片的实验现象是铝片融化,但是不脱落,原因是氧化铝熔点高于铝,包在铝的外面。
【题型】填空题
【结束】
20
【题目】将镁、铝的混合物共0.2mol,溶于200mL4mol·L—1的盐酸溶液中,然后再滴加2mol·L—1的NaOH溶液。请回答下列问题:
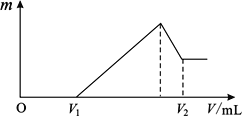
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160mL时,则金属粉末中n(Mg)=_______________mol;
(2)0~V1段发生的反应的离子方程式为_______________;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+ 刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=_______________mL;
(4)试计算V2的值: V2=_______________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素中,占细胞总量97%的一组是( )
A. C、H、O、N、P、S
B. C、Fe、K、Ca、B、Mg
C. N、P、S、K、Ca、Mg
D. Fe、Mn、B、Zn、Cu、Co
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能大量共存的是( )
A.H+、AlO2-、CO32-B.K+、Ba2+、SO42-
C.NH4+、OH-、NO3-D.Fe3+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )
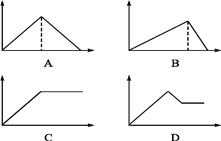
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com