


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
A、质子数35、中子数45的原子:
| ||||||||
| B、HClO的结构式:H-Cl-O | ||||||||
C、过氧化钠的电子式:Na:
| ||||||||
D、硫离子的结构示意图: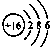 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、几千万年前地球上一条恐龙体内的某个原子可能在你的身体里 |
| B、在化学变化中,分子可以再分,离子和原子不可以再分 |
| C、一定条件下,金属钠可以成为绝缘体 |
| D、一定条件下,水在20℃时能凝固成固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 共价键 | H-H | C-H | C≡C |
| 能量变化/kJ?mol-1 | 436 | 413 | 812 |
查看答案和解析>>
科目:高中化学 来源: 题型:
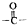 c.-CHO
c.-CHO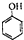 和
和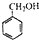 可用的试剂是
可用的试剂是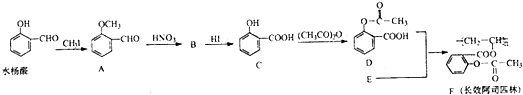
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 食物 | 橘子汁 | 朝鲜泡菜 | 牛奶 | 鸡蛋清 |
| 近似pH范围 | 3.0~4.0 | 3.2~3.6 | 6.3~6.6 | 7.6~8.0 |
| A、鸡蛋清显碱性 |
| B、胃酸过多的人应少吃朝鲜泡菜 |
| C、橘子汁能使石蕊试液变红 |
| D、牛奶比鸡蛋清的碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
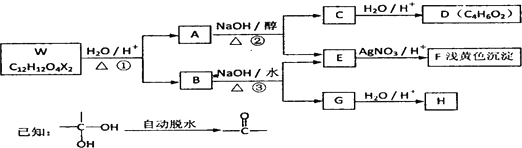
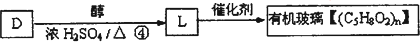
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com