
【题目】同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
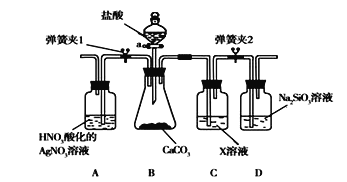
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2当…时,关闭活塞a。
请回答:
(1)盛放盐酸的仪器名称是___________。
(2)通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
A.酸性 B.还原性 C.氧化性 D.挥发性
(3)C装置中的X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写出的现象是___________________。
若通入D中的CO2足量,D中发生反应的离子方程式是______________________。
(5)碳、硅的非金属性逐渐减弱的原因是_____________________(从原子结构角度加以解释)。
【答案】分液漏斗 A、D NaHCO3 D中出现白色沉淀 SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3- 电子层数增加,半径增大,原子核对最外层电子的吸引能力减弱,非金属性减弱
【解析】
B中发生盐酸与碳酸钙的反应,生成氯化钙、水、二氧化碳;A中挥发的HCl能与硝酸银发生反应看到白色沉淀,X为碳酸氢钠溶液,与挥发的盐酸反应,可除去二氧化碳中混有的HCl;D中发生二氧化碳与硅酸钠溶液的反应,依据强酸制被弱酸原理探究得出碳的非金属性比硅强,据此分析作答。
(1)根据仪器构造可知,盛放盐酸的仪器名称是分液漏斗;
(2)A中看到白色沉淀,B装置中挥发的盐酸能与盐反应,可知盐酸具有的酸性、挥发性,故答案为:AD;
(3) C装置的作用是除HCl气体,X为碳酸氢钠溶液,与挥发的盐酸反应,可除去二氧化碳中混有的HCl,故答案为:NaHCO3;
(4)D中发生二氧化碳与硅酸钠溶液的反应,该反应为Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,步骤Ⅱ中未写的操作和现象是关闭弹簧夹1,打开弹簧夹2,当D中出现白色沉淀后,则证明碳的非金属性大于硅,故答案为:D中出现白色沉淀;
(5)碳、硅的非金属性逐渐减弱的原因是两者位于同一主族,随着电子层数增加,半径增大,原子核对最外层电子的吸引能力减弱,非金属性减弱。


科目:高中化学 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生放热反应:2A(g)+B(s)![]() C(g)+D(g),下列描述中不能说明反应已达到平衡状态的是( )
C(g)+D(g),下列描述中不能说明反应已达到平衡状态的是( )
A. 容器内温度不变
B. 混合气体的密度不变
C. 混合气体的平均相对分子质量不变
D. 单位时间内生成nmol D,同时消耗2nmol A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是( )
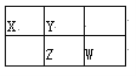
A. Z元素位于周期表的第三周期第VA族
B. X、W元素的最高价氧化物对应水化物的酸性:W强于X
C. Y元素的气态氢化物的热稳定性比Z的高
D. X与W形成共价化合物XW2, X的原子半径比Y小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)已知反应NO2(g)+CO(g) = NO(g) +CO2(g)的能量变化如图所示,下列说法正确的是________。
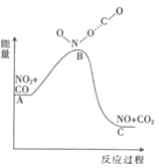
A.图中A→B的过程为放热过程
B.1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和
C.该反应为氧化还原反应
D.1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
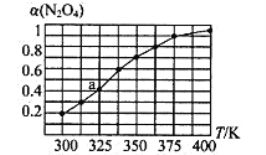
①由图推测该反应的△H___0(填“>”或“<”),理由为________________。
②图中a点对应温度下,已知N2O4的起始压强为108 kPa,则该温度下反应的平衡常数Kp=_________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________,在下左图上标出的点中,能表示反应达到平衡状态的点为__________(填字母代号)。

(3)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
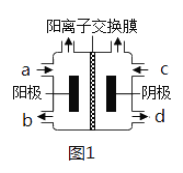
①收集到(CH3)4NOH的区域是______(填a、b、c或d)。
②写出电解池总反应(化学方程式)___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸滴定10.00 mL0.1mol/L的碱MOH,滴定过程中加入醋酸的体积(V) 与溶液中lg[c (H+)/c(OH-)]的关系如图所示(V=0时,

lg[c (H+)/c(OH-)]=-12)。下列说法正确的是( )
A. MOH的电离方程式为MOH![]() M++OH-
M++OH-
B. a 点:V(CH3COOH)= 10.00mL
C. b点:c(CH3COO-)>c(H+ )>c(M+)>c(OH-)
D. 25℃时,CH3COO-的水解平衡常数为(10/17)×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的( )
A. 实验室用固体氯化铵和熟石灰共热制取NH3:2NH4++Ca(OH)2![]() 2NH3↑+ Ca2++2H2O
2NH3↑+ Ca2++2H2O
B. 铜与浓硝酸反应: 3Cu + 8H+ + 2NO3- =3Cu2+ + 2NO↑ + 4H2O
C. 氨水与FeCl3反应:3OH- + Fe3+ =Fe(OH)3↓
D. 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O===2HCO![]() +SO32-
+SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,参照元素在表中的位置,请按要求回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)用序号回答:
①—元素中,_________形成的气态氢化物最稳定;化学性质最不活泼原子是_______;_______的最高价氧化物的水化物呈两性;用中文“![]() ”(ào)命名的第118号元素与_____同一族。
”(ào)命名的第118号元素与_____同一族。
(2)用“>”“<”回答:
原子半径:⑥___________⑦;离子半径:⑤___________⑧。
(3)用化学用语回答:
⑥的原子结构示意图是______________;②和形成的化合物的结构式是___________;
⑩的气态氢化物的化学式是____________;的最高价含氧酸的化学式是____________。
(4)①和④两种元素的原子按2:1组成的常见化合物的电子式为________________。①和③两种元素的原子按5:1组成化合物,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,它的电子式为___________________。
(5)⑦⑧两元素相比较,金属性较强的是_________________(填名称),可以验证该结论的实验是_____________(填字母)。
A 将在空气中放置已久的这两种元素的块状单质分别放入热水中
B 将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C 将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D 比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)医院里检验糖尿病的方法是将病人尿液加入到CuSO4和NaOH的混合液中,加热后产生砖红色沉淀,说明病人的尿中含有_______;
(2)①用乙烯制备氯乙烷的化学方程式:________________,该反应的类型是__________。
②用苯制备硝基苯的化学方程式_______________,该反应的类型是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com