
| A. | CDEBA | B. | ECDAB | C. | BAEDC | D. | CDBAE |
分析 A和B的最高价氧化物对应的水化物呈碱性,且碱性A>B,则金属性:A>B,由同周期元素从左到右元素的金属性逐渐减弱判断原子序数大小;
元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,由同周期元素从左到右元素的非金属性逐渐增强判断原子序数大小;
五种元素形成的简单离子中,E的离子半径最小,E应为金属,以此解答该题.
解答 解:A和B的最高价氧化物对应的水化物呈碱性,且碱性A>B,则金属性:A>B,由同周期元素从左到右元素的金属性逐渐减弱可知:原子序数B>A;
元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,C和D的最高价氧化物的水溶液呈酸性,且酸性C强于D,可知非金属性C>D,原子序数C>D;
五种元素形成的简单离子中,E的离子半径最小,E应为金属,A、B、E对应离子的核外电子排布相同,核电核数越大半径越小,故原子序数E>B>A,
D为非金属,E为金属,在同周期中,原子序数D>E,
则它们的原子序数由大到小的顺序C>D>E>B>A,
故选A.
点评 本题考查元素的位置性质结构关系应用,为高频考点,题目难度中等,掌握元素周期律的递变规律是解题关键,注意基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 降低温度,当A质量不变时,说明该反应已达平衡 | |
| B. | 若D为气体,再加入1mol A,平衡正向移动,A的转化率增大 | |
| C. | 升高温度,正反应的平衡常数增大 | |
| D. | 若D为固体,再加入1mol A,平衡不移动,A在混合气体中的百分含量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
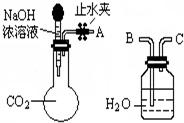 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中存在电离平衡:(NH4)2SO4?2NH4++SO42- | |
| B. | 向溶液中滴加少量浓硫酸,c(NH4+)与c(SO42-)均增大 | |
| C. | 加水稀释,溶液中所有离子的浓度均减小 | |
| D. | 溶液中:c(SO42-)=2c(NH4+)+2c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的物质的量浓度不再改变 | |
| B. | 混合气的密度不再随时间而变化 | |
| C. | 容器内的压强不随时间而变化 | |
| D. | 平衡混合气体的平均相对分子质量不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 5.6g | C. | 11.2g | D. | 1.4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com