
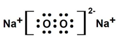
���� ��1��FeSO4���л�ԭ�ԣ��ɱ�����������������
��2����������Ϊ���ӻ����
��3����CO�����������Һ������Ӧ��
����觡�ˮ������Ҫ�ɷ�Ϊ�������裬��ʯ����Ҫ�ɷ�ΪC��
��ͬ������������ͬԪ����ɣ�
��Ũ��ˮ�μӵ�FeCl3��Һ�п���ȡFe��OH��3������
��������ƿ��ת��Һ��ʱ�������������ԽӴ�������ƿ��ƿ�ڣ���ֹҺ��������
����ɫ��ӦΪԪ�ص����ʣ�
��MgO��NaOH��Һ����Ӧ��
��SiO2����ᷴӦ�������Σ�
��3mol����Fe����������ȫת��ΪFe3O4��Fe�Ļ��ϼ۱�Ϊ+2��+3�ۣ�ʧȥ8NA�����ӣ�
���ú��轺�����۵���С����ʳƷһ���ܷ��װ��������Fe�۵Ļ�ԭ�ԣ��ɷ�ֹʳƷ��������
��4�����ᱻ�ȶ����ֽ����ɶ���������
��5��������Һ����������������Һ��Ӧ�������������������ᱵ������
��� �⣺��1��FeSO4���л�ԭ�ԣ��ɱ��������������������ڿ����з�ֹ����������Ũ�ȼ�С���ⶨ���ƫС���ʴ�Ϊ��ƫС��
��2����������Ϊ���ӻ��������ʽΪ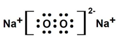 ���ʴ�Ϊ��
���ʴ�Ϊ��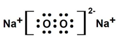 ��
��
��3����CO�����������Һ������Ӧ��Ϊ������������ʴ���
����觡�ˮ������Ҫ�ɷ�Ϊ�������裬��ʯ����Ҫ�ɷ�ΪC���ʴ���
��ͬ������������ͬԪ����ɣ�����ɻ����ʴ���
��Ũ��ˮ�μӵ�FeCl3��Һ�п���ȡFe��OH��3���������ܵõ����壬�ʴ���
��������ƿ��ת��Һ��ʱ�������������ԽӴ�������ƿ��ƿ�ڣ���ֹҺ������������ȷ��
����ɫ��ӦΪԪ�ص����ʣ���һ��Ϊ����Һ���ʴ���
��MgO��NaOH��Һ����Ӧ���ʴ���
��SiO2����ᷴӦ�������Σ���������������ʴ���
��3mol����Fe����������ȫת��ΪFe3O4��Fe�Ļ��ϼ۱�Ϊ+2��+3�ۣ�ʧȥ8NA�����ӣ�����ȷ��
���ú��轺�����۵���С����ʳƷһ���ܷ��װ��������Fe�۵Ļ�ԭ�ԣ��ɷ�ֹʳƷ������������ȷ��
�ʴ�Ϊ���ݢ�⣻
��4�����ᱻ�ȶ����ֽ����ɶ�����������Ӧ�Ļ�ѧ����ʽΪ4HNO3=4NO2+O2+2H2O���ʴ�Ϊ��4HNO3=4NO2+O2+2H2O��
��5��������Һ����������������Һ��Ӧ�������������������ᱵ��������Ӧ�����ӷ���ʽΪ2Al3++3SO42-+3Ba2++6OH-=2Al��OH�� 3��+3BaSO4����
�ʴ�Ϊ��2Al3++3SO42-+3Ba2++6OH-=2Al��OH�� 3��+3BaSO4����
���� ���⿼���Ϊ�ۺϣ���Ƕȿ���Ԫ�ػ�����֪ʶ��Ϊ��Ƶ���㣬������ѧ���ķ���������Ԫ�ػ�����֪ʶ���ۺ���������õĿ��飬�ѶȲ���ע����ػ���֪ʶ�Ļ��ۣ�


 ÿ�α���ϵ�д�
ÿ�α���ϵ�д� ��ѧ����ϵ�д�
��ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��� | c��ClNO��/mol•L-1 | v/mol•L-1•s-1 |
| �� | 0.30 | 3.6��10-8 |
| �� | 0.60 | 1.44��10-7 |
| �� | 0.90 | 3.24��10-7 |
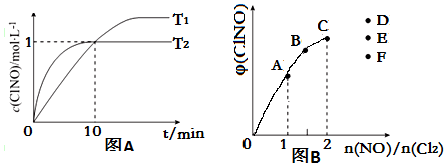
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������Ѽ�·�ˡ����������γɵ����ܽ��ж����ЧӦ | |
| B�� | ����������������֮�Ϊͭ�����ù��̷������û���Ӧ | |
| C�� | ������һ�գ���ˮ�����գ���ȡ֭���������϶������ص���ȡ���ڻ�ѧ�仯 | |
| D�� | �����ж�����̼��������������ɡ�����ЧӦ������Ҫԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | CO2 | CO | |||
| A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| C | 1000 | 1 | 2 | c | d | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
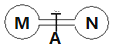 ����ʱ�������ݻ���ͬ����ƿ�зֱ�ʢ��M��N�������壨ͬ��ͬѹ����ȡ�µ��ɼ�A��ʹ����ƿ�ڵ������ֽӴ�����ͼ���������ڵ�ѹǿ�ɴ�С��˳���ǣ�������
����ʱ�������ݻ���ͬ����ƿ�зֱ�ʢ��M��N�������壨ͬ��ͬѹ����ȡ�µ��ɼ�A��ʹ����ƿ�ڵ������ֽӴ�����ͼ���������ڵ�ѹǿ�ɴ�С��˳���ǣ�������| ��� | �� | �� | �� | �� |
| ����M | H2S | NH3 | HI | NO |
| ����N | SO2 | HCl | Cl2 | O2 |
| A�� | ��=�ܣ��٣��� | B�� | �ۣ��ܣ��٣��� | C�� | �ܣ��ۣ��ڣ��� | D�� | �ܣ��ۣ��٣��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com