
分析 (1)可逆反应达到平衡状态时,正逆反应速率相等,各物质的物质的量、物质的量浓度、百分含量及由此引起的一系列物理量不变;
(2)同一可逆反应同一时间段内各物质的反应速率之比等于计量数之比,据此计算二氧化氮反应速率,再根据n=vtV计算二氧化氮物质的量;
(3)该反应是一个反应前后气体计量数之和不变的放热反应,升高温度、加入催化剂、增大压强都增大反应速率;
(4)若上述容器为绝热容器(与外界无热交换),该反应的正反应是放热反应,所以相当于升高温度,反应速率加快.
解答 解:(1)a.该反应是一个反应前后气体计量数之和不变的可逆反应,所以压强始终不变,所以体系压强保持不变不能说明该反应达到平衡状态,故错误;
b.混合气体颜色保持不变,说明各物质浓度不变,所以该反应达到平衡状态,故正确;
c.SO3和NO的体积比保持不变时该反应可能达到平衡状态也可能没有达到平衡状态,与反应物初始浓度及转化率有关,所以不能据此判断平衡状态,故错误;
d.无论该反应是否达到平衡状态,都存在每消耗n mol SO3的同时生成n mol NO2,所以不能据此判断平衡状态,故错误;
故选b;
(2)同一可逆反应同一时间段内各物质的反应速率之比等于计量数之比,v(NO2)=v(NO)=0.005mol•L-1•s-1,则参加反应的n(NO)=vtV=0.005mol•L-1•s-1×20s×2L=0.2mol,
故答案为:0.2;
(3)该反应是一个反应前后气体计量数之和不变的放热反应,升高温度、加入催化剂、增大压强都增大反应速率,降低温度反应速率降低,故选bc;
(4)若上述容器为绝热容器(与外界无热交换),该反应的正反应是放热反应,所以相当于升高温度,反应速率加快,则缩短反应达到平衡时间,故选b.
点评 本题考查化学平衡状态判断、反应速率有关计算、化学平衡影响因素、反应速率影响因素等知识点,侧重考查学生分析判断能力,注意:只有反应前后改变的物理量才能作为平衡状态判断依据,易错点是(4)题,相当于升高温度.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | X原子核外有6个电子层 | B. | X的碳酸正盐不溶于水 | ||
| C. | X的最高化合价为+3价 | D. | X的氢氧化物是一种弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
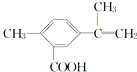
| A. | 该有机物的分子式为C11H12O2 | |
| B. | 1 mol该物质最多能与4 mol H2发生加成反应 | |
| C. | 该有机物能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀 | |
| D. | 该有机物在一定条件下,可以发生取代、氧化、酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
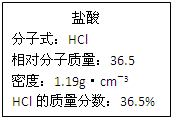 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的电负性呈周期性变化 | |
| B. | 元素的第一电离能呈周期性变化 | |
| C. | 元素原子的核外电子排布呈周期性变化 | |
| D. | 元素的金属性、非金属性呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、HCO3-、NO3- | B. | K+、Fe3+、NO3-、SCN- | ||
| C. | H+、Cr2O72-、SO42-、K+ | D. | H+、Na+、S2O32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | ------- |
| V (NaOH)mL | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
| m(沉淀)/g | 1.29 | 3.09 | 4.89 | 5.4 | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | 溴水 | C. | AgNO3溶液 | D. | 淀粉碘化钾溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com