
(14分)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
a、写出由磷酸钙矿制取白磷总的反应方程式_____________________________。
b、上述反应中SiO2起何作用?______________________________________。
(2)白磷在热的浓氢氧化钾溶液中岐化得到一种次磷酸盐(KH2PO2)和一种气体 (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在 之间(已知磷酸的各级电离常数为:K1= 7.1×103 K2 = 6.3×108 K3 =4.2×1013 lg7.1≈0.9 lg6.3≈0.8 lg≈0.6) 。Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性,其原因是 (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。
⑴a、2Ca3(PO4)2+6SiO2+10C 6CaSiO3+P4+10CO (2分)b、生成CaSiO3放出一定的能量使反应热△H降低;CaSiO3的熔点比SiO2低,成为熔融态浮在表面,对白磷有保护作用 (2分)
6CaSiO3+P4+10CO (2分)b、生成CaSiO3放出一定的能量使反应热△H降低;CaSiO3的熔点比SiO2低,成为熔融态浮在表面,对白磷有保护作用 (2分)
⑵PH3(2分)⑶2.1~7.2 (4分) 3Ca2++2HPO4-=Ca3(PO4 )2↓+2H+(2分) ⑷3mol(2分)
【解析】
试题分析:(1)a、白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到:①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1,②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1,③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1,这说明反应中还有硅酸钙和CO生成,因此由磷酸钙矿制取白磷总的反应方程式为2Ca3(PO4)2+6SiO2+10C 6CaSiO3+P4+10CO。
6CaSiO3+P4+10CO。
b、由于白磷易被氧化,生成CaSiO3放出一定的能量,而CaSiO3的熔点比SiO2低,是硅酸钙成为熔融态浮在表面,对白磷有保护作用 。
(2)白磷在热的浓氢氧化钾溶液中岐化得到一种次磷酸盐(KH2PO2)和一种气体,则根据氧化还原反应电子得失守恒可知,该气体中P元素的化合价要低于0价,因此该气体是PH3。
(3)如果磷酸只发生一级电离,则根据电离常数可知溶液的pH=3—0.9=2.1。根据二级电离常数可知溶液的pH=8—0.8=7.2,所以工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在2.1~7.2 之间。Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,则发生反应3Ca2++2HPO4-=Ca3(PO4 )2↓+2H+,因此溶液则显酸性。
(4)根据方程式可知被氧化的P化合价从0价升高到+5价,失去5个电子,即1mol白磷失去20mol电子。硫酸铜中铜元素的化合价从+2价降低到+1价,得到1个电子。因此根据电子得失守恒可知60molCuSO4能氧化白磷的物质的量是60mol÷20=3mol。
考点:考查白磷制备、性质、氧化还原反应、离子反应以及电离常数应用等


科目:高中化学 来源:2014-2015学年四川省德阳市四校高三3月联合考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.1 mol [Cu(NH3)4]2+ 中含有σ键的数目为12NA
B.0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA
C.分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA
D.用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:选择题
仅用下表提供的玻璃仪器(非玻璃仪器和药品任选),不能实现相应实验目的的是
选项 | 实验目的 | 玻璃仪器 |
A. | 验证Na2CO3和NaHCO3的热稳定性 | 酒精灯、试管、导气管 |
B | 实验室用浓氨水和生石灰制备氨气 | 普通漏斗、烧杯、玻璃棒 |
C | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 |
D | 分离乙醇和乙酸乙酯的混合物 | 分液漏斗、烧杯 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
物质 组别 | 甲 | 乙 | 丙 |
A | FeCl2 | Cl2 | NaOH |
B | SiO2 | NaOH | HF |
C | AlCl3 | KOH | H2SO4 |
D | SO2 | NaOH | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
化学与生产、生活、环境保护等密切相关。下列叙述正确的是
A.绿色食品是生产时不使用化肥农药,不含任何化学物质的食品
B.新型材料聚酯纤维、光导纤维都属于有机高分子材料
C.医药中常用酒精来消毒,是因为酒精能够使病毒的蛋白质发生变性
D.CO2的水溶液呈酸性,CO2的大量排放会导致酸雨的形成
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:选择题
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是
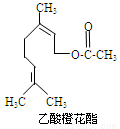
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属
于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A.①②③ B.①②⑤ C.①②⑤⑥ D.①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省仙桃天门潜江高三上学期期末联考理综化学试卷(解析版) 题型:实验题
(14分)4,7—二甲基香豆素(熔点:132.6℃)是一种重要的香料,广泛分布于植物界中,由间—甲苯酚为原料的合成反应如下: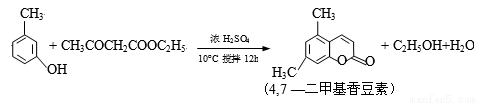
实验装置图如下:

主要实验步骤:
步骤1.向装置a中加入60mL浓硫酸,并冷却至0℃以下,搅拌下滴入间—甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物。
步骤2.保持在10℃下,搅拌12h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗产品
步骤3.粗产品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0g。
(1)图中仪器名称:a 。
(2)简述装置b中将活塞上下部分连通的目的 。
(3)浓H2SO4需要冷却至0℃以下的原因是 。
(4)反应需要搅拌12h,其原因是 。
(5)本次实验产率为 。
(6)实验室制备乙酸乙酯的化学反应方程式 ,用 (填药品名称)收集粗产品,用 (填操作名称)的方法把粗产品分离。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省八市高三年级三月联考理综化学试卷(解析版) 题型:选择题
根据原子结构及元素周期律的知识,下列叙述正确的是
A.由于相对分子质量:HCl>HF,故沸点:HCl>HF
B.硅处于金属与非金属的过渡位置,硅可用作半导体材料
C.由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在
D.Cl-、S2-、Ca2+、K+半径逐渐减小
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列关于中和滴定的操作错误的是
A.滴定前需要检查滴定管是否漏水
B.用对应加入的溶液润洗的仪器有:酸式滴定管、锥形瓶
C.用标准盐酸测定氨水的浓度,最适宜使用的指示剂是甲基橙
D.已知浓度滴定未知溶液,终点读数时俯视滴定管的刻度,会造成计算值偏低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com