
【题目】t℃时,某一气态平衡体系中含有X、Y、Z、W四种气体物质,此温度下发生反应的平衡常数表达式为:![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K增大 ,则正反应为吸热反应
B.增大压强,W质量分数增加
C.增大X浓度,平衡向正反应方向移动
D.升高温度,若混合气体的平均相对分子质量变大,则正反应是放热反应
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值。下列说法正确的是
A.25℃,1LpH=13的氢氧化钡溶液中含OH-的数目为0.2NA
B.12.0gNaHSO4晶体中阳离子和阴离子的总数为0.3NA
C.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
D.4.2gCaH2与水完全反应,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源危机当前是一个全球性问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是__(填字母)。
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,不使用煤、石油等化石燃料
D.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
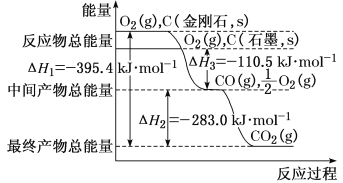
①在通常状况下,金刚石和石墨相比较,__(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为ΔH=___。
②12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为__kJ。
(3)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497kJ·mol-1。N2(g)+O2(g)=2NO(g)ΔH=+180.0kJ·mol-1。NO分子中化学键的键能为__。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向体积为2L的恒容密闭容器中通入2molN2和6molH2,在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g)。实验测得反应经5min后达到平衡,此时混合物的总物质的量为5.6mol,求:
2NH3(g)。实验测得反应经5min后达到平衡,此时混合物的总物质的量为5.6mol,求:
(1)平衡时NH3的浓度为___mol·L-1。
(2)0~5min内,v(H2)=___mol·L-1·min-1。
(3)反应达到平衡时,N2的转化率为___。
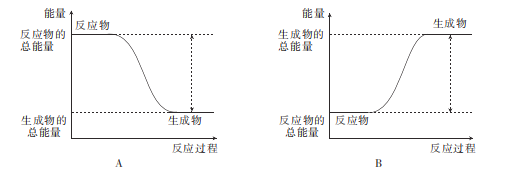
(4)下列图象中能反映该反应的能量变化的是___(填标号)。
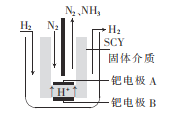
(5)若以N2和H2合成氨的反应设计如图所示的原电池,则通入N2的一极为__(填“正”或“负")极;负极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 实验室用氯化铵和熟石灰制氨:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
B. NaOH溶液与NH4Cl溶液混合加热:NH4+ +OH-![]() NH3·H2O
NH3·H2O
C. 氨水中加盐酸:NH3·H2O+H+=NH4++H2O
D. 氨水中加入氯化铁溶液:Fe2++2NH3·H2O=2NH4++Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如下图所示,图中含酚废水中有机物可用C6H6O表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是( )
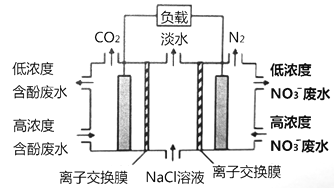
A. 左池的pH值降低
B. 右边为阴离子交换膜
C. 右池电极的反应式:2NO3-+10e-+12H+= N2↑+ 6H2O
D. 当消耗0.1molC6H6O,在标准状况下将产生0.28mol氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工艺即化工技术或化学生产技术,指将原料物主要经过化学反应转变为产品的方法和过程,包括实现这一转变的全部措施。工业上用赤铁矿(含![]() 、
、![]() ,也含有
,也含有![]() 、
、![]() 、
、![]() 、
、![]() 等)制备绿矾
等)制备绿矾![]() 的工艺流程如下图:
的工艺流程如下图:
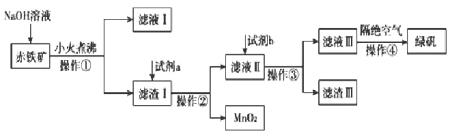
(1)操作①的名称是______________。
(2)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为_________、__________。
(3)向滤渣Ⅰ中加入过量的试剂a名称为__________,加入过量试剂b后所得滤渣Ⅲ的主要成分化学式为__________。
(4)操作③需要的玻璃仪器主要包括________________。
(5)操作④需要隔绝空气的主要原因可能是什么?___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的氧化剂与还原剂及部分产物如下所示:2Mn2+ + 5IO4— + …… → 2MnO4— + ……已知该反应体系还包括H+、H2O与另一种含碘微粒。对于该氧化还原反应说法正确的是
A.Mn2+是氧化剂,IO4—是还原剂
B.体系中另一种含碘微粒为I—
C.随着反应进行,溶液pH不断上升
D.每有1 mol IO4—参加反应,转移2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶体硅是良好的半导体材料,它的发现和使用引起了计算机的一场“革命”。它可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
下列说法不正确的是( )
A.步骤③中氢气作还原剂
B.硅和二氧化硅都能用作计算机“芯片”
C.步骤①的化学方程式为:SiO2+2C![]() Si+2CO↑
Si+2CO↑
D.步骤①②③中发生的反应都属于氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com