
| A、6.4 | B、4.8 |
| C、3.2 | D、2.4 |
| 28g |
| 56g/mol |
| 2 |
| 3 |
| 1.6mol |
| 0.5L |


科目:高中化学 来源: 题型:
| A、①③ | B、②④ |
| C、①③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.5 mol?L-1 |
| B、1 mol?L-1 |
| C、0.5 mol?L-1 |
| D、0.25 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X2Y3 |
| B、XY |
| C、X2Y |
| D、XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X能形成化学式为X(OH)3的碱 |
| B、X能形成化学式为NaXO3的含氧酸钠盐 |
| C、X原子的最外层电子数和核电荷数不可能为偶数 |
| D、X能与某些金属元素或非金属元素形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、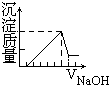 |
B、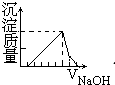 |
C、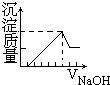 |
D、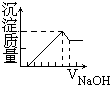 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com