
| A. | 铝的化学性质稳定 | |
| B. | 铝在常温时与氧气不反应 | |
| C. | 铝具有金属性,也具有非金属性 | |
| D. | 铝与氧气反应生成一层致密的氧化物薄膜 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L乙烯含有的共用电子对数为5NA | |
| B. | 8.0gCu2S和CuO的混合物中含有的铜原子数为0.1NA | |
| C. | 电解饱和食盐水时,阳极生成22.4L气体时,转移的电子数为2NA | |
| D. | 室温下向1L pH=1的醋酸溶液中加水,所得溶液中H+数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | |||
| X | Y | Z |
| A. | 原子半径大小:X>Y>Z | |
| B. | W、Y两种元素都能与氧元素形成化合物WO2、YO2 | |
| C. | 最高价氧化物对应水化物的酸性:W>Y>Z | |
| D. | W元素的单质能从X的氧化物中置换出X单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
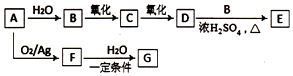 A是一种重要的化工原料,C、F的分子式都为C2H4O,F是没有不饱和键的环状有机物,G的分子式为C2H6O2,G中含有两个相同的官能团,转化关系如图:
A是一种重要的化工原料,C、F的分子式都为C2H4O,F是没有不饱和键的环状有机物,G的分子式为C2H6O2,G中含有两个相同的官能团,转化关系如图: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①比②多 | B. | ②比①多 | C. | 一样多 | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤燃烧时产生大量CO2 | B. | 煤不完全燃烧产生大量CO | ||
| C. | 煤燃烧时产生大量SO2 | D. | 工业生产中排放大量烟尘 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com