
����Ŀ����Ǧ���������������������Ǧ��Ⱦ�������أ���ҵ�ϴӷ�Ǧ���ص�Ǧ���л���Ǧ�Ĺ���������ͼ 
��1��Ǧ���ص��ܷ�ӦΪPb+PbO2+2H2SO4�T2PbSO4+2H2O�������طŵ�ʱ�ĸ�����ӦʽΪ �� �ŵ��õ缫�������������С�����䡱����
��2����������Na2SO3�������� ��
��3��д�������֤��PbCO3�����Ѿ�ϴ�Ӹɾ���ʵ����������� ��
��4������NH4HCO3��NH3H2OΪ����ת������Ҳ�ɶ����������еĺ�Ǧ������д�����ͼ2��NH4HCO3��NH3H2O�����Ժ�Ǧ�����������ʵ�Ӱ�죺
��ͼ�ο��Կ�����Ӧѡ��NH4HCO3��NH3H2O����Ϊ���������������������²���۴�ĸҺ�ɻ�ø���ƷΪ ��
��5�������ʹ�ô�Ǧ�ʹ�Ǧ���缫��PbSiF6������ʣ��ɽ��д�Ǧ�������������ĵ缫������ �� �����ĵ缫��ӦʽΪ ��
���𰸡�
��1��Pb��2e��+SO42��=PbSO4������
��2����Ϊ��ԭ����PbO2��ԭ
��3��ȡ�������һ��ϴ��Һ���Թ��У�������������ٵ��������Ȼ�����Һ���������������֤���Ѿ�ϴ�Ӹɾ�
��4��2.0����NH4��2SO4
��5����Ǧ��Pb2++2e��=Pb
���������⣺��1��Ǧ������Pb�����������ڵ������Һ�����ᣬ����Ǧ������ˮ���ʵ缫��Ӧ����ʽΪ��Pb��2e��+SO42��=PbSO4 �� ���ŷ�Ӧ�Ľ��У��缫�����������Դ��ǣ�Pb��2e��+SO42��=PbSO4������2������ټ���Na2SO3��PbO2����������ԭ��Ӧ����PbSO4 �� ���Բ�����м���Na2SO3����������Ϊ��ԭ����PbO2��ԭ�����Դ��ǣ���Ϊ��ԭ����PbO2��ԭ����3�����ϴ��Һ�в�������������Ӿ�֤��ϴ�Ӹɾ�������鷽��Ϊ��ȡ�������һ��ϴ��Һ���Թ��У�������������ٵ��������Ȼ�����Һ���������������֤���Ѿ�ϴ�Ӹɾ������Դ��ǣ�ȡ�������һ��ϴ��Һ���Թ��У�������������ٵ��������Ȼ�����Һ���������������֤���Ѿ�ϴ�Ӹɾ�����4������ͼ���ѿ���NH4HCO3��NH3H2O����Ϊ����������2.0��ʱ����Ч�ʺܸߣ�����ʱ��NH4��2SO4�ǿ������Σ����Ի�����ĸҺ�У����Դ��ǣ�2.0����NH4��2SO4����5����Ǧ����������Ϊ��Ǧ������Ϊ��Ǧ���������ҺΪ������Ǧ���ӵ���Һ�����������ĵ缫��ӦʽΪPb2++2e��=Pb�����Դ��ǣ���Ǧ��Pb2++2e��=Pb��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܹ��ü��ܴ�С���͵��ǣ� ��
A.�����Ļ�ѧ���ʱ������ȶ�
B.���³�ѹ�£����Һ̬����ʹ�̬
C.ϡ������һ����ѷ�����ѧ��Ӧ
D.��ͬ״̬�£��������ܶȱȿ����Ĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������200mL����KNO3��Cu��NO3��2�Ļ����Һ������c��NO3�� ��=3molL��l �� ��ʯī���缫������Һ����ͨ��һ��ʱ����������ռ���2.24L���壨��״�������ٶ�������Һ�����Ϊ200mL��������˵������ȷ���ǣ� ��
A.�������й�ת��0.4 mol����
B.ԭ���Һ��c��K+��Ϊ2.0 molL��l
C.���õ���Cu������Ϊ6.4 g
D.������Һ��c��H+��Ϊ0.1 molL��l
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������XͶ�����Y�У������ɺ��ɫ�������ų�һ����ɫ���壬�����岻��ȼ�գ��Ҳ�������ˮ����X��Y����������( )
A. �ƺ��Ȼ����Һ B. �����ռ���Һ
C. �������ƺ��Ȼ�������Һ D. п��ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E�������ʶ�������ͬ��Ԫ��X�����������ʼ��ת����ϵ���£�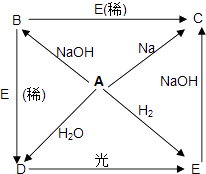
��֪A��һ�ֻ���ɫ���壬�ɴ��ƶϣ�
��1�����������ʵĻ�ѧʽΪ��
A�� B�� C D�� E��
��2��д��ˮ��Һ�з������л�ѧ��Ӧ�Ļ�ѧ����ʽ��
A��D��
D��E��
B��D�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʻ���Һ������CO2��Ӧ���ǣ� ��
A. Na2O2B. CaCl2��Һ
C. NaOH��ҺD. Na2CO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ1��ͭпԭ���ʾ��ͼ��ͼ2�У�x���ʾʵ��ʱ���������ĵ��ӵ����ʵ�����y���ʾ�� �� 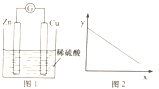
A.ͭ��������
B.c��Zn2+��
C.c��H+��
D.c��SO42����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ����̼����Ԫ�صİٷֺ�����ͬ��������ϩ�Ȳ���ͬϵ���ֲ���ͬ���칹�����
A. ������B. ����C. ����D. CH3CH=CH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )��
A. ����ԭ������������IJ��ϱ����ǽ���
B. ��ԭ�����,����������һ���Ǹ���,�õ缫����ԭ
C. ʵ������������ȡ����,�����ô�п��ϡ���ᷴӦ
D. ԭ��ؿ��������ڲ�������ȫ��ת��Ϊ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com