
| A、CuO→Cu |
| B、KCl→AgCl |
| C、Fe→FeCl3 |
| D、HNO3→NO |
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
| A、水气化 氯化钠熔化 |
| B、干冰升华 加热氯化铵 |
| C、过氧化氢加入二氧化锰制氧气 碘化氢气体受热分解 |
| D、大理石高温生成二氧化碳,碘晶体升华为碘蒸气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、仅由实验①可推出肯定含有SO42-,不含Cl- |
| B、该无色溶液肯定含有NH4+、K+、Al3+、SO42- |
| C、该无色溶液肯定不含K+、Mg2+、HCO3-、Cl-、MnO4-、I- |
| D、不能确定该无色溶液是否含有K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
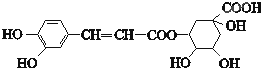
| A、分子式为C16H18O9 |
| B、0.1mol绿原酸最多与0.8mol NaOH反应 |
| C、能发生取代反应和消去反应 |
| D、能与Na2CO3反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、NO3-、Fe2+、Na+ |
| B、K+、Ba2+、OH-、SO42- |
| C、Fe2+、NO3-、I-、K+ |
| D、Cu2+、NH4+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾水解的离子方程式:Al3++3H2O?Al(OH)3↓+3H+ | ||||
| B、电镀时,要在铁上镀银,则正极为银,电极反应式为:Ag++e-═Ag | ||||
C、以石墨作电极电解氯化镁溶液:2Cl-+2H2O
| ||||
D、表示氢气燃烧热的化学方程式:H2(g)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量SO2气体通入到NaClO溶液中:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B、把Fe(OH)3溶于氢氟酸:Fe(OH)3+3H+═Fe3++3H2O |
| C、向H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ |
| D、在苯酚钠溶液中通入少量的二氧化碳气体:C6H5O-+CO2+H2O═C6H5OH+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 15 |
| 16 |
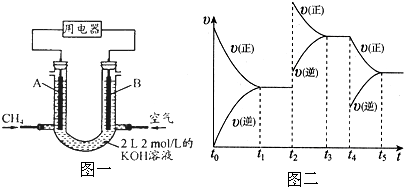
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com