
| A.CH4O(l)+3/2 O2(g)="=" CO2(g)+2H2O(l); △H=-725.76 kJ·mol-1 |
| B.2CH4O(l)+3 O2(g)="=" 2CO2(g)+4H2O(l); △H=+1451.6 kJ·mol-1 |
| C.2CH4O(l)+3 O2(g)="=" 2CO2(g)+4H2O(l); △H=-22.68 kJ·mol-1 |
| D.CH4O(l)+3/2 O2(g)="=" CO2(g)+2H2O(g); △H=-725.76 kJ·mol-1 |
科目:高中化学 来源:不详 题型:填空题
 2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
 。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)
。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g)===CO(g) △H2
O2(g)===CO(g) △H2| A.①③ | B.①④ | C.②④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 )作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知
)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知 完全发生上述反应放出
完全发生上述反应放出 的热量,热化学方程式是:
的热量,热化学方程式是:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ·mol-1 CH4(g)+HC≡CH(g) △H2=+32.4kJ·mol-1
CH4(g)+HC≡CH(g) △H2=+32.4kJ·mol-1  CH3CH=CH2(g)+H2(g)的△H= kJ·mol-1。
CH3CH=CH2(g)+H2(g)的△H= kJ·mol-1。 HCO3-+H+的电离平衡常数Ka1= 。(已知:10-5.60=2.5×10-6)
HCO3-+H+的电离平衡常数Ka1= 。(已知:10-5.60=2.5×10-6)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.26.0kJ | B.51.9kJ | C.155.8kJ | D.467.3kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | a | 945 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO+3H2的焓变△H=_______。
CO+3H2的焓变△H=_______。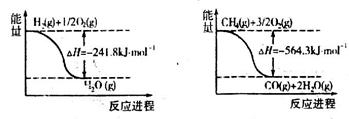
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com