
| A. | 可用浓硫酸干燥H2、NH3、Cl2等气体 | |
| B. | 向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO42- | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| D. | 氨水、铵盐受热都易发生化学变化 |
分析 A.浓硫酸能与氨气反应;
B.氯化钡中含有氯离子,溶液中含银离子、硫酸根离子可以生成白色沉淀;
C.不能在量筒中稀释浓硫酸;
D.一水合氨受热分解生成氨气、铵盐受热易分解.
解答 解:A.浓硫酸具有吸水性,可以作干燥剂,浓硫酸能与氨气反应,不能干燥氨气,故A错误;
B.氯化钡中含有氯离子,溶液中含银离子、硫酸根离子可以生成白色沉淀,所以产生白色沉淀不一定含有SO42-,故B错误;
C.不能在量筒中稀释浓硫酸,应该把浓硫酸倒入含有水的烧杯中,故C错误;
D.一水合氨受热分解生成氨气,铵盐受热易分解,所以氨水、铵盐受热都易发生化学变化,故D正确.
故选D.
点评 本题考查了物质的性质和用途,题目难度不大,注意把握浓硫酸的性质以及用作干燥剂时不能干燥还原性和碱性气体.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
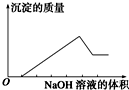 某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )| A. | ①②⑤ | B. | ①③④ | C. | ②⑥⑦ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑤ | C. | ③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
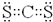 ,ci2与ce2比较,沸点较高的是CS2(写分子式).
,ci2与ce2比较,沸点较高的是CS2(写分子式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
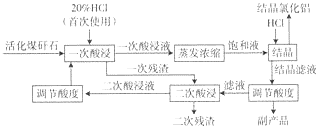
| HCl气体体积/(m3.L-1) | 结晶效率/% | HCl利用效率/% |
| 0.0375 | 11.8 | 93.2 |
| 0.075 | 31.5 | 89.8 |
| 0.1225 | 59.0 | 83.2 |
| 0.15 | 68.0 | 74.9 |
| 0.1875 | 71.0 | 67.8 |
| 0.225 | 73.1 | 59.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的原子晶体和分子晶体互为同素异形体 | |
| B. | 在一定条件下,CO2原子晶体转化为分子晶体是物理变化 | |
| C. | CO2的原子晶体和CO2分子晶体具有相同的物理性质 | |
| D. | 在CO2的原子晶体中,每个碳原子周围结合四个氧原子,每个氧原子周围结合两个碳原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com