
ЁОЬтФПЁПЖўМзУб(CH3OCH3)жиећжЦШЁH2ЃЌОпгаЮоЖОЁЂЮоДЬМЄадЕШгХЕуЁЃЛиД№ЯТСаЮЪЬтЃК
(1) CH3OCH3КЭO2ЗЂЩњЗДгІЂёЃК CH3OCH3(g)+![]() O2 (g) =2CO(g)+3H2(g) ЁїH
O2 (g) =2CO(g)+3H2(g) ЁїH
МКжЊЃКCH3OCH3(g) =CO(g)+H2(g)+CH4(g) ЁїH= a kJ/mol
CH4(g) +![]() O2 (g) = CO(g)+2H2O(g) ЁїH= b kJ/mol
O2 (g) = CO(g)+2H2O(g) ЁїH= b kJ/mol
H2(g)+![]() O2 (g) = H2O(g) ЁїH= c kJ/mol
O2 (g) = H2O(g) ЁїH= c kJ/mol
ЂйдђЗДгІЂёЕФЁїH=_________________ (гУКЌaЁЂbЁЂcЕФДњЪ§ЪНБэЪО)ЁЃ
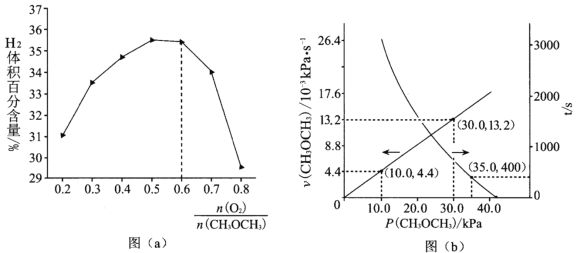
ЂкБЃГжЮТЖШКЭбЙЧПВЛБфЃЌЗжБ№АДВЛЭЌНјСЯБШЭЈШыCH3OCH3КЭO2ЃЌЗЂЩњЗДгІЂёЁЃВтЕУЦНКтЪБH2ЕФЬхЛ§АйЗжКЌСПгыНјСЯЦјжа![]() ЕФЙиЯЕШчЭМ(a)ЫљЪОЁЃЕБ
ЕФЙиЯЕШчЭМ(a)ЫљЪОЁЃЕБ![]() >0.6ЪБЃЌH2ЕФЬхЛ§АйЗжКЌСППьЫйНЕЕЭЃЌЦфзюжївЊдвђЪЧ_____
>0.6ЪБЃЌH2ЕФЬхЛ§АйЗжКЌСППьЫйНЕЕЭЃЌЦфзюжївЊдвђЪЧ_____![]() ЬюБъКХ
ЬюБъКХ![]() ЁЃ
ЁЃ
a Й§СПЕФO2Ц№ЯЁЪЭзїгУ
b Й§СПЕФO2гыH2ЗЂЩњИБЗДгІЩњГЩH2O
c ![]() >0.6ЪБЦНКтЯђФцЗДгІЗНЯђвЦЖЏ
>0.6ЪБЦНКтЯђФцЗДгІЗНЯђвЦЖЏ
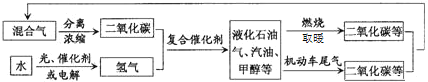
(2)TЁцЪБЃЌдкИеадЗДгІЦїжаЭЈШыCH3OCH3ЃЌЗЂЩњЗДгІЂђЃКCH3OCH3(g) =CO(g)+H2(g)+CH4(g) ЁїH>0ЃЌВтЕУШнЦїФкГѕЪМбЙЧПЮЊ41.6kPaЃЌЗДгІЙ§ГЬжаЗДгІЫйТЪv(CH3OCH3)ЁЂЪБМфtгыЗжбЙP(CH3OCH3)ЕФЙиЯЕШчЭМ(b)ЫљЪОЁЃ
Ђйt=400sЪБЃЌCH3OCH3ЕФЗжНтТЪІС=______(БЃСє2ЮЛгааЇЪ§зж)ЃЛ
ЂкЗДгІЫйТЪТњзуv(CH3OCH3)=k Pn(CH3OCH3)ЃЌn=_____ЃЌk=______s-1ЃЛ400sЪБv(CH3OCH3)=___________kPaЁЄs-1ЁЃ
ЂлвЛЖЮЪБМфКѓЗДгІДяЕНЦНКтЃЌВтЕУЬхЯЕЕФзмбЙЧПЮЊ121.6 kPaЃЌдђИУЗДгІЕФЦНКтГЃЪ§Kp=_____kPa2ЁЃ
ЂмШєЬсИпИУИеадЗДгІЦїЕФЮТЖШЃЌдйДЮДяЕНЦНКтКѓЬхЯЕЕФбЙЧПP_____121.6 kPaЃЈЬюЁАДѓгкЁБЁЂЁАЕШгкЁБЛђЁАаЁгкЁБЃЉЃЌдвђЪЧ________ЁЃ
ЁОД№АИЁП(a+b-2c)kJ/mol b 16% 1 0.00044 0.0154 40000 Дѓгк ЮТЖШЬсИпЃЌЬхЛ§ВЛБфЃЌзмбЙЧПЬсИп;ЗДгІЂђЮЊЮќШШЗДгІЃЌЮТЖШЬсИпЃЌЦНКтгввЦЃЌЬхЯЕЮяжЪЕФСПдіМгЃЌзмбЙЧПЬсИп
ЁОНтЮіЁП
CH3OCH3КЭO2ЗЂЩњЗДгІЂёЃК CH3OCH3(g)+![]() O2 (g) =2CO(g)+3H2(g) ЁїH
O2 (g) =2CO(g)+3H2(g) ЁїH
МКжЊЃКCH3OCH3(g) =CO(g)+H2(g)+CH4(g) ЁїH= a kJ/mol
CH4(g) +![]() O2 (g) = CO(g)+2H2O(g) ЁїH= b kJ/mol
O2 (g) = CO(g)+2H2O(g) ЁїH= b kJ/mol
H2(g)+![]() O2 (g) = H2O(g) ЁїH= c kJ/mol
O2 (g) = H2O(g) ЁїH= c kJ/mol
(1)ЂйЂйCH3OCH3(g)ЈTCO(g)+H2(g)+CH4(g)ЁїHЃНa kJ/molЃЌЂкCH4(g) +![]() O2 (g) = CO(g)+2H2O(g) ЁїHЃНb kJ/molЃЌЂлH2(g)+
O2 (g) = CO(g)+2H2O(g) ЁїHЃНb kJ/molЃЌЂлH2(g)+![]() O2 (g) = H2O(g) ЁїHЃНc kJ/molЃЌИљОнИЧЫЙЖЈТЩЂй+ЂкЉЂлЁС2МЦЫуЕУЗДгІЂёЃКCH3OCH3(g)+
O2 (g) = H2O(g) ЁїHЃНc kJ/molЃЌИљОнИЧЫЙЖЈТЩЂй+ЂкЉЂлЁС2МЦЫуЕУЗДгІЂёЃКCH3OCH3(g)+![]() O2 (g)ЈT2CO(g)+3H2(g)ЕФьЪБфЁїHЃЛ
O2 (g)ЈT2CO(g)+3H2(g)ЕФьЪБфЁїHЃЛ
ЂкЕБ![]() ЃО0.6ЪБЃЌH2ЕФЬхЛ§АйЗжКЌСППьЫйНЕЕЭЕФдвђПЩФмЪЧбѕЦјКЭЧтЦјЗЂЩњСЫЗДгІЃЛ
ЃО0.6ЪБЃЌH2ЕФЬхЛ§АйЗжКЌСППьЫйНЕЕЭЕФдвђПЩФмЪЧбѕЦјКЭЧтЦјЗЂЩњСЫЗДгІЃЛ
(2)ЂйtЃН400sЪБЃЌCH3OCH3ЗжбЙP(CH3OCH3)ЃН35.0kPaЃЌВтЕУШнЦїФкГѕЪМбЙЧПЮЊ41.6 kPaЃЌзЊЛЏТЪЃН![]() ЁС100%ЃН
ЁС100%ЃН![]() ЁС100%ЃЛ
ЁС100%ЃЛ
ЂкЗДгІЫйТЪТњзуv(CH3OCH3)ЃНkPn(CH3OCH3)ЃЌНЋ(10.0ЃЌ4.4)КЭ(30.0ЃЌ13.2)СНЕуЪ§жЕДњШыv(CH3OCH3)ЃНkPn(CH3OCH3)жаЃЌМЦЫуkЁЂnЃЌНјЖјЕУЕНv(CH3OCH3)гыP(CH3OCH3)ЕФЙиЯЕЪНЃЌзюКѓМЦЫу400sЪБЕФv(CH3OCH3)ЃЛ
ЂлДяЕНЦНКтЪБЃЌВтЕУЬхЯЕЕФзмбЙЧПPзмЃН121.6 kPaЃЌНсКЯШ§ааМЦЫуЕУЕНЮяжЪЕФСПКЭИїЮяЦНКтЗжбЙЃЌДњШыЗДгІЕФЦНКтГЃЪ§KpЃН![]() жаМЦЫуKpЃЛ
жаМЦЫуKpЃЛ
ЂмЩ§ИпЮТЖШЃЌЦјЬхЬхЛ§ВЛБфЃЌзмбЙЧПдіДѓЃЌЭЌЪБЗДгІЂђЃКCH3OCH3(g)ЈTCO(g)+H2(g)+CH4(g)ЁїHЃО0ЃЌЫљвдЩ§ИпЮТЖШЃЌЦНКте§ЯђвЦЖЏЃЌЦјЬхЕФЮяжЪЕФСПдіДѓЃЌЦјЬхЕФбЙЧПдіДѓЁЃ
(1)ЂйCH3OCH3(g)ЈTCO(g)+H2(g)+CH4(g)ЁїHЃНa kJ/molЃЌЂкCH4(g) +![]() O2 (g) = CO(g)+2H2O(g) ЁїHЃНb kJ/molЃЌЂлH2(g)+
O2 (g) = CO(g)+2H2O(g) ЁїHЃНb kJ/molЃЌЂлH2(g)+![]() O2 (g) = H2O(g) ЁїHЃНc kJ/molЃЌИљОнИЧЫЙЖЈТЩЂй+ЂкЉЂлЁС2МЦЫуЗДгІЂёЃКCH3OCH3(g)+
O2 (g) = H2O(g) ЁїHЃНc kJ/molЃЌИљОнИЧЫЙЖЈТЩЂй+ЂкЉЂлЁС2МЦЫуЗДгІЂёЃКCH3OCH3(g)+![]() O2 (g)ЈT2CO(g)+3H2(g)ЕФьЪБфЁїHЃН(a+bЉ2c)KJ/molЃЛ
O2 (g)ЈT2CO(g)+3H2(g)ЕФьЪБфЁїHЃН(a+bЉ2c)KJ/molЃЛ
ЂкгЩЭМЯѓЗжЮіПЩжЊЃЌЕБ![]() ЃО0.6ЪБЃЌH2ЕФЬхЛ§АйЗжКЌСППьЫйНЕЕЭЕФдвђПЩФмЪЧЃКЙ§СПЕФO2гыH2ЗЂЩњИБЗДгІЩњГЩH2OЃЌЙЪД№АИЮЊЃКbЃЛ
ЃО0.6ЪБЃЌH2ЕФЬхЛ§АйЗжКЌСППьЫйНЕЕЭЕФдвђПЩФмЪЧЃКЙ§СПЕФO2гыH2ЗЂЩњИБЗДгІЩњГЩH2OЃЌЙЪД№АИЮЊЃКbЃЛ
(2)ЂйtЃН400 sЪБЃЌCH3OCH3ЗжбЙP(CH3OCH3)ЃН35.0kPaЃЌВтЕУШнЦїФкГѕЪМбЙЧПЮЊ41.6 kPaЃЌзЊЛЏТЪЃН![]() ЁС100%ЃН16%ЃЛ
ЁС100%ЃН16%ЃЛ
ЂкЗДгІЫйТЪТњзуv(CH3OCH3)ЃНkPn(CH3OCH3)ЃЌНЋ(10.0ЃЌ4.4)КЭ(30.0ЃЌ13.2)СНЕуЪ§жЕДњШыv(CH3OCH3)ЃНkPn(CH3OCH3)жагаЃК10.0nkЃН4.4ЁС10Љ3ЃЌ30.0nkЃН13.2ЁС10Љ4ЃЌНтЕУkЃН0.00044ЁЂnЃН1ЃЌЫљвдv(CH3OCH3)ЃН0.00044P(CH3OCH3)ЃЌ400 sЪБЃЌP(CH3OCH3)ЃН35.0KPaЃЌдђv(CH3OCH3)ЃН0.00044ЁС35.0ЃН0.0154kPa/sЃЛ
ЂлДяЕНЦНКтЪБЃЌВтЕУЬхЯЕЕФзмбЙЧПPзмЃН121.6 kPaЃЌНсКЯШ§ааМЦЫуЕУЕНЮяжЪЕФСПЃЌЩшCH3OCH3ЮяжЪЕФСПЮЊ1molЃЌЗДгІЯћКФМзУбЮяжЪЕФСПЮЊxЃЌ
CH3OCH3(g)CO(g)+H2(g)+CH4(g)
Ц№ЪМСП(mol) 1 0 0 0
БфЛЏСП(mol) x x x x
ЦНКтСП(mol) 1Љx x x x
ИљОнЦјЬхЕФбЙЧПжЎБШЕШгкЦјЬхЮяжЪЕФСПжЎБШга(1+2x)ЃК1ЃН121.6ЃК41.6ЃЌНтЕУxЃН0.96molЃЌ1ЉxЃН0.04molЃЌЦјЬхзмЮяжЪЕФСПЃН1+2xЃН2.92molЃЌKpЃН kPa2Ёж40000kPa2ЃЌЙЪД№АИЮЊЃК40000ЃЛ
kPa2Ёж40000kPa2ЃЌЙЪД№АИЮЊЃК40000ЃЛ
ЂмЩ§ИпЮТЖШЃЌЦјЬхЬхЛ§ВЛБфЃЌзмбЙЧПдіДѓЃЌЭЌЪБЗДгІЂђЃКCH3OCH3(g)ЈTCO(g)+H2(g)+CH4(g)ЁїHЃО0ВЂЧвЦјЬхЬхЛ§діДѓЃЌЫљвдЩ§ИпЮТЖШЃЌЦНКте§ЯђвЦЖЏЃЌЦјЬхЕФЮяжЪЕФСПдіДѓЃЌЦјЬхЕФбЙЧПдіДѓЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк1ЁС105PaКЭ298KЪБЃЌНЋ1molЦјЬЌABЗжзгЗжРыГЩЦјЬЌAдзгКЭBдзгЫљашвЊЕФФмСПГЦЮЊМќФм(kJЁЄmol-1)ЁЃЯТУцЪЧвЛаЉЙВМлМќЕФМќФмЃК(вбжЊАБЗжзгжагаШ§ИіЕШМлЕФЕЊЧтЙВМлМќ)
ЙВМлМќ | H2Зжзг | N2Зжзг | NH3Зжзг |
МќФм(kJЁЄmol-1) | 436 | 945 | 391 |
ЃЈ1ЃЉИљОнЩЯБэжаЕФЪ§ОнХаЖЯЙЄвЕКЯГЩАБЕФЗДгІЪЧ__(ЬюЁАЮќШШЁБЛђЁАЗХШШЁБ)ЗДгІЃЛ
ЃЈ2ЃЉдк298KЪБЃЌШЁ1molN2КЭ3molH2ЗХШывЛУмБеШнЦїжаЃЌдкДпЛЏМСДцдкЯТНјааЗДгІЃЌРэТлЩЯЩњГЩ2molNH3ЪБЗХГіЛђЮќЪеЕФШШСПЮЊQЃЌдђQЮЊ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгавЛжжБЛГЦЮЊЁАШэЕчГиЁБЕФжНжЪЕчГиЃЌЦфзмЗДгІЮЊЃКZnЃЋ2MnO2ЃЋH2O=ZnOЃЋ2MnOOHЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ

A.ИУЕчГижаZnзїе§МЋ
B.ZnЕчМЋЩЯЗЂЩњЛЙдЗДгІ
C.ИУЕчГиЙЄзїЪБЕчСїгЩZnОЕМЯпСїЯђMnO2
D.ЕБ6.5gZnЭъШЋШмНтЪБЃЌСїОЕчТЗЕФЕчзгИіЪ§дМЮЊ1.204ЁСl023
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁППЦбЇМве§дкбаОПНЈСЂШчЭМЫљЪОЕФЖўбѕЛЏЬМаТбЛЗЬхЯЕвдНтОіШевцМгОчЕФЮТЪваЇгІЕШЮЪЬтЃЌЙиЯЕЭМжаФмЗДгГЕФЛЏбЇЙлЕуЛђЛЏбЇЫМЯыгаЃЈ ЃЉ
ЂйЖўбѕЛЏЬМвВЪЧвЛжжживЊЕФзЪдДЃЛ
ЂкЙтФмЛђЕчФмПЩвдзЊЛЏЮЊЛЏбЇФмЃЛ
ЂлШМЩеЪБЛЏбЇФмПЩвдзЊЛЏЮЊШШФмЃЛ
ЂмЮоЛњЮяКЭгаЛњЮяПЩвдЯрЛЅзЊЛЏЃЛ
ЂнЛЏбЇБфЛЏжадЊЫижжРрЪЧЪиКуЕФ
A.ЂйЂкЂлB.ЂйЂмЂнC.ЂйЂкЂмЂнD.ЂйЂкЂлЂмЂн
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЧрняЫиЪЧЬўЕФКЌбѕбмЩњЮяЃЌЮЊЮоЩЋеызДОЇЬхЃЌвзШмгкБћЭЊЁЂТШЗТКЭБНжаЃЌдкМзДМЁЂввДМЁЂввУбЁЂЪЏгЭУбжаПЩШмНтЃЌдкЫЎжаМИКѕВЛШмЃЌШлЕуЮЊ156ЁЋ157ЁцЃЌШШЮШЖЈадВюЃЌЧрняЫиЪЧИпаЇЕФПЙХБвЉЁЃвбжЊЃКввУбЗаЕуЮЊ35ЁцЃЌДгЧрняжаЬсШЁЧрняЫиЕФЗНЗЈжЎвЛЪЧвднЭШЁдРэЮЊЛљДЁЕФЃЌжївЊгаввУбНўШЁЗЈКЭЦћгЭНўШЁЗЈЁЂввУбНўШЁЗЈЕФжївЊЙЄвеЮЊЃК

ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЖдЧрняНјааИЩдяЦЦЫщЕФФПЕФЪЧ__________ЃЛ
ЃЈ2ЃЉВйзїЂёашвЊЕФВЃСЇвЧЦїжївЊгаЃКЩеБЁЂВЃСЇАєЁЂ__________ЃЌВйзїЂђЕФУћГЦЪЧ__________ЃЛВйзїЂѓЕФУћГЦЪЧ__________ЃЛ
ЃЈ3ЃЉЭЈГЃгУШМЩеЕФЗНЗЈВтЖЈгаЛњЮяЕФЗжзгЪНЃЌПЩдкШМЩеЪвФкНЋгаЛњЮябљЦЗгыДПбѕдкЕчТЏМгШШЯТГфЗжШМЩеЃЌИљОнВњЦЗЕФжЪСПШЗЖЈгаЛњЮяЕФзщГЩЁЃШчЭМЫљЪОЕФЪЧгУШМЩеЗЈШЗЖЈЧрняЫиЗжзгЪНЕФзАжУЁЃ
ЂйАДЩЯЪіЫљИјЕФВтЪдаХЯЂЁЃзАжУЕФСЌНгЫГађгІЪЧ__________ЃЈУПИізАжУЯогУвЛДЮЃЉЁЃ
ЂкИУЪЕбщзАжУПЩФмЛсВњЩњЮѓВюЃЌдьГЩВтЖЈКЌбѕСПЦЋЕЭЃЌИФНјЗНЗЈЪЧ__________ЃЛ
ЂлЧрняЫибљЦЗЕФжЪСПЮЊ28.2 gЁЃгУКЯРэИФНјКѓЕФзАжУНјааЪдбщЃЌГЦЕУAЙмдіжи66 gЃЌBЙмдіжи19.8 gЃЌдђВтЕУЧрняЫиЕФзюМђЪНЪЧ__________ЁЃ
ЂмвЊШЗЖЈИУгаЛњЮяЕФЗжзгЪНЃЌЛЙБиаыжЊЕРЕФЪ§ОнЪЧ__________ЁЃ
ЃЈ4ЃЉФГбЇЩњЖдЧрняЫиЕФаджЪНјааЬНОПЃЎНЋЧрняЫиМгШыКЌгаNaOHЁЂЗгЬЊЕФЫЎШмвКжаЃЌЧрняЫиЕФШмНтСПНЯаЁЃЌМгШШВЂНСАшЃЌЧрняЫиЕФШмНтСПдіДѓЃЌЧвШмвККьЩЋБфЧГЃЌгыЧрняЫиЛЏбЇаджЪЯрЫЦЕФЮяжЪЪЧ__________ЃЈЬюзжФИДњКХЃЉ
AЃЎввДМ BЃЎввЫс CЃЎЦЯЬбЬЧ DЃЎввЫсввѕЅ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖдгкБНввЯЉ(![]() )ЕФЯТСаа№ЪіЃК
)ЕФЯТСаа№ЪіЃК
ЂйЫљгаЕФдзгВЛПЩФмЙВУц ЂкПЩШмгкЫЎ ЂлПЩШмгкБНжа ЂмФмЪЙЫсадKMnO4ШмвКЭЪЩЋ
ЂнПЩЗЂЩњМгОлЗДгІ Ђо1molБНввЯЉгыH2ЗДгІзюЖрЯћКФ4molH2ЁЃЦфжаЭъШЋе§ШЗЕФвЛзщЪЧЃЈ ЃЉ
A. ЂйЂкЂмЂнB. ЂлЂмЂнЂоC. ЂйЂлЂнЂоD. ЂкЂлЂмЂн
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПWЁЂXЁЂYЁЂZЮЊЖЬжмЦкдЊЫиЃЌЫќУЧдкжмЦкБэжаЕФЯрЖдЮЛжУШчЭМЫљЪОЃЌШєетЫФжждЊЫиЕФдзгзюЭтВуЕчзгЪ§жЎКЭЮЊ24ЃЌдђЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
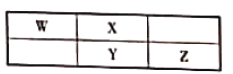
A.зюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяЕФЫсадЃКZ>Y
B.WЕФзюЕЭМлЧтЛЏЮягыЩйСПZ2ЗДгІЃЌВњЮяГ§W2ЭтЃЌЛЙгавЛжжбЮЃЌЦфЫЎШмвКГЪЫсад
C.дкдЊЫижмЦкБэжаЃЌ114КХ(РрЧІ)дЊЫигыWдЊЫиВЛЮЛгкЭЌвЛжїзх
D.YЁЂZПЩаЮГЩYZ2ЁЂY2Z2ЕШЗжзгЃЌЧАепГЃгУзїЯ№НКСђЛЏМС
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП1,3-ЖўвьБћЯЉЛљБНЪЧЙЄвЕЩЯГЃгУЕФНЛСЊМСЃЌПЩгУгкжЦБИИпадФмГЌЗжзгОлКЯЮяЃЌЦфНсЙЙШчЭМЫљЪОЁЃЯТСагаЙи1,3-ЖўвьБћЯЉЛљБНЕФЫЕЗЈДэЮѓЕФЪЧЃЈ ЃЉ
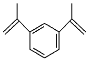
A.ЦфвЛТШДњЮяга6жж
B.гывКфхЛьКЯКѓМгШыЬњЗлПЩЗЂЩњШЁДњЗДгІ
C.ЗжзгжаЫљгаЬМдзгПЩФмДІгкЭЌвЛЦНУц
D.ФмЗЂЩњМгОлЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃКKClO3ЃЋ6HCl(ХЈ)=KClЃЋ3Cl2ЁќЃЋ3H2OЃЌШчЭМЫљЪОЃЌНЋЩйСПЪдМСЗжБ№ЗХШыХрбјУѓжаЕФЯргІЮЛжУЃЌЪЕбщЪБНЋХЈбЮЫсЕЮдкKClO3ОЇЬхЩЯЃЌВЂгУБэУцУѓИЧКУЁЃЯТБэжагЩЪЕбщЯжЯѓЕУГіЕФНсТлЭъШЋе§ШЗЕФЪЧ(ЁЁЁЁ)
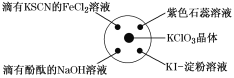
бЁЯю | ЪЕбщЯжЯѓ | НсТл |
A | ЕЮгаKSCNЕФFeCl2ШмвКБфКь | Cl2ОпгаЛЙдад |
B | ЕЮгаЗгЬЊЕФNaOHШмвКЭЪЩЋ | Cl2ОпгаЫсад |
C | зЯЩЋЪЏШяШмвКЯШБфКьКѓЭЪЩЋ | Cl2ОпгаЦЏАзад |
D | KIЕэЗлШмвКБфГЩРЖЩЋ | Cl2ОпгабѕЛЏад |
A.AB.BC.CD.D
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com