
【题目】锂—液态多硫电池具有能量密度高、储能成本低等优点,以熔融金属锂、熔融硫和多硫化锂[Li2Sx(2≤x≤8)]分别作两个电极的反应物,固体Al2O3陶瓷(可传导Li+)为电解质,其反应原理如图所示。下列说法错误的是

A. 该电池比钠一液态多硫电池的比能量高
B. 放电时,内电路中Li+的移动方向为从a到b
C. Al2O3的作用是导电、隔离电极反应物
D. 充电时,外电路中通过0.2mol电子,阳极区单质硫的质量增加3.2g
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】氮及氮的化合物在生产生活中有着重要的用途,NH3、HNQ3等是重要化工产品。
(1)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
①2C+ O2→2CO
②C+H2O(g)→CO+H2
③CO+H2O(g)→CO2+H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:表中x=_______m3,实际消耗了_____kg焦炭。
气体 | CO | N2 | CO2 | H2 | O2 |
体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
(2)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:2CO(g)+SO2(g)![]() 2CO2(g)+S(1) ΔH<0。若向2L 恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
2CO2(g)+S(1) ΔH<0。若向2L 恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示

①与实验a相比,c组改变的实验条件可能是____________。
②用P0表示开始时总压强,P表示平衡时总压强,.用α表示SO2的平衡转化率,则α表达式为________。
(3)已知N2O4![]() 2NO2,N2O4与NO2共存的温度是264-413K,低于溶点264K时,全部为无色的N2O4 晶体,达到264K时N2O4开始分解,沸点294K时成为红棕色的混合气体,温度高与413K时,气体又变为无色。(2NO2
2NO2,N2O4与NO2共存的温度是264-413K,低于溶点264K时,全部为无色的N2O4 晶体,达到264K时N2O4开始分解,沸点294K时成为红棕色的混合气体,温度高与413K时,气体又变为无色。(2NO2![]() 2NO+O2 )。在1L的密闭容器中发生反应N2O4
2NO+O2 )。在1L的密闭容器中发生反应N2O4![]() 2NO2达到平衡状态。
2NO2达到平衡状态。
①若此时为标准状态下(273K 101KPa),再向其中加入4.6g纯的NO2,则达到平衡时混合物的颜色____(和原平衡状态比,填选项字母,下同)
A.增大(加深) B.减小(变浅) C.不变 D.不能确定
②若此时为25℃,101KPa下,再向其中加入4.6g纯的NO2,则达到平衡时混合物的颜色______,混合物中NO2的体积分数___________。
(4)查阅资料可知:常温下,Ksp[Ag(NH3)2-]= 1.00×107。Ksp[AgC1]=2.50×10-10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq),该反应平衡常数的表达式为K稳=__________;
Ag(NH3)2+(aq),该反应平衡常数的表达式为K稳=__________;
②计算得到可逆反应AgCl (s)+2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=______,1 L 1 mol/L氨水中最多可以溶解AgCl_______mol(保留2位有效数字)
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=______,1 L 1 mol/L氨水中最多可以溶解AgCl_______mol(保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体是一种常见的分散系,回答下列问题。
(1)向大量沸腾的蒸馏水中逐滴加入___________溶液,继续煮沸至________________________________,停止加热,可制得Fe(OH)3胶体;
(2)向Fe(OH)3胶体中滴加氢碘酸(HI水溶液)至过量,观察到的现象为________________________________________,该反应的离子方程式为________________________________________________________;
(3)如由图所示,通电后,Fe(OH)3胶体粒子向_________电极移动(填“X”或“Y”)。
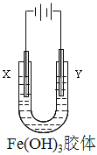
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述表示可逆反应N2 + 3H2 ![]() 2NH3一定处于平衡状态的是
2NH3一定处于平衡状态的是
A. N2、H2、NH3的百分含量相等
B. 单位时间,消耗a mol N2的同时消耗3a mol H2
C. 单位时间,消耗a molN2的同时生成3a mol H2
D. 反应若在定容的密器中进行,温度一定时,压强不随时间改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组化合物中,不论二者以任何比例混合,只要总质量一定,则完全燃烧时消耗O2的质量和生成水的质量不变的是( )
A、CH4、C2H6 B、C2H6、C3H6 C、C2H4、C3H6 D、C2H4、C3H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(22Ti)、铁(26Fe)及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为_____________,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有_________种。
(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是_____________。
(3)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C![]() N)和异硫氰酸(H-N=C=S)。
N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒______________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为______________;
③异硫氰酸的沸点比硫氰酸沸点高的原因是__________________________________。
(4)TiCl3可用作烯烃定向聚合的催化剂,如:nCH3CH=CH2![]() 。该反应涉及的物质中碳原子的杂化轨道类型有_______________________;反应涉及的元素中电负性最大的是_____________________________。
。该反应涉及的物质中碳原子的杂化轨道类型有_______________________;反应涉及的元素中电负性最大的是_____________________________。
(5)Ti的某氧化物和CaO相互作用能形成钛酸盐的晶胞结构如图所示(Ti4+位于立方体的顶点,Ca2+处于立方体的中心)。该晶体中,Ti4+和周围________个O2-紧邻;若该晶胞的密度为dg/cm3则钛氧键的键长为________cm(用含NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氢气在氯气中燃烧时产生苍白色火焰,在反应过程中,破坏1 mol氢气的化学键消耗的能量为Q1 kJ,破坏1 mol氯气的化学键消耗的能量为Q2kJ ,形成1 mol氯化氢的化学键释放的能量为Q3kJ,下列关系式正确的是
A. Q1 + Q2 > Q3 B. Q1 + Q2 < Q3 C. Q1 + Q2 > 2Q3 D. Q1 + Q2 < 2Q3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com