
| 选项 | 叙述I | 叙述II |
| A | 苯甲酸的溶解度随温度升高而增大 | 用蒸发浓缩、冷却结晶、过滤,除去苯甲酸中混有的泥沙 |
| B | NH4Cl受热容易分解 | 加热NH4Cl制备NH3 |
| C | SO2具有漂白性 | SO2能使酸性KMnO4溶液褪色 |
| D | 某温度下,碳酸的K1=4.4×10-7,次氯酸的K=2.98×10-8 | 用CO2和NaClO溶液制备HClO |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯甲酸溶于水,而泥沙不溶于水;
B.氯化铵分解后,极易化合生成氯化铵;
C.SO2能使酸性KMnO4溶液褪色,发生氧化还原反应;
D.用CO2和NaClO溶液制备HClO,发生强酸制取弱酸的反应.
解答 解:A.苯甲酸溶于水,而泥沙不溶于水,则溶于水后过滤可除杂,叙述不具有因果关系,故A错误;
B.氯化铵分解后,极易化合生成氯化铵,则不能利用加热NH4Cl制备NH3,叙述II不合理,故B错误;
C.SO2能使酸性KMnO4溶液褪色,发生氧化还原反应,与二氧化硫的还原性有关,叙述不具有因果关系,故C错误;
D.用CO2和NaClO溶液制备HClO,发生强酸制取弱酸的反应,由碳酸的K1=4.4×10-7,次氯酸的K=2.98×10-8可知碳酸酸性强,叙述合理且具有因果关系,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、气体的制备原理、氧化还原反应、酸性比较等,把握物质的性质、化学反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 明矾常作净水剂 | |
| B. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| C. | 在水果贮藏室中,放几块被KMnO4溶液浸透过的“砖块”,可延长水果保存时间 | |
| D. | 汽车尾气中的CO、NO等都是汽油和柴油的不完全燃烧产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要使用合理的催化剂及载体,就可完全清除NO和CO | |
| B. | 使用催化剂只能改变反应的速率不能改变反应的平衡常数 | |
| C. | 假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO) | |
| D. | 恒容条件下,通入惰性气体可提高NO转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q=92 kJ | B. | Q<92 kJ | C. | Q>92 kJ | D. | Q=194kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
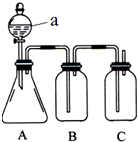 某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱.供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液
某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱.供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 元素存在形式 |
| 1200-1350K | Fe3+部分转变为Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20.5% | B. | 18.6% | C. | 17.6% | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com