
已知:A为淡黄色固体,E、X常温下为气体,A、B、C、D含有相同的金属离子,其转化关系如右(部分产物已略去)。
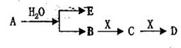
请回答下列问题:
(1) 常温常压下,3.9gA与足量的氷充分反应放出热量akJ,写出该反应的热化学方程式________
(2) 向500mL0.3mol/L的B溶液中缓慢通入2.24L(标准状况下)的气体X,则所得混合溶液中各离子浓度由大到小的顺序是________________
(3) 已知20°C时的溶解度:S(Na2CO3)=21.2g,S(NaHCO3)=9.6g。则20°C恒温条件下向121.2g饱和碳酸钠溶液中通入足量的CO2气体,理论上可以析出 NaHCO3 ________g (小数点后保留1位)
(4) 现有甲、乙两瓶无色溶液,已知它们可能是以下四种溶液:MgCl2溶液、 AlCl3溶液、NaOH溶液、氨水中的两种,现做如下实验:
①取440mL甲与120mL乙反应,产生1.56g白色沉淀M
②取440mL乙与120mL甲反应,也产生1. 56g白色沉淀M
③取120mL甲溶液与400mL乙溶液反应,则产生3.12g白色沉淀M;通过必要的计算和推理判定:甲溶液为__________溶液,乙溶液为________溶液。
(1)2Na2O2(s)+2H2O(l)=4NaOH(aq)+O2(g) △H=-40akJ·mol-1
(2)c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
(3)24.3
(4)AlCl3;NaOH
【解析】
试题分析:A是淡黄色固体且可与水反应,A为Na2O2,则E为O2,B为NaOH,X为气体,且可和NaOH发生特征反应,则X为CO2,C为Na2CO3,D为NaHCO3。
(1)3.9gNa2O2的物质的量是0.05mol,写热化学方程式时Na2O2的化学计量数是2,因此反应热为-40akJ·mol-1。
(2)根据反应方程式2NaOH+CO2=Na2CO3+H2O及Na2CO3+H2O+CO2=2NaHCO3,可知0.5×0.3=0.15mol NaOH与2.24÷22.4=0.1mol CO2反应,反应后得到的是含有等物质的量的Na2CO3和NaHCO3的混合溶液,CO32-的水解程度大于HCO3-,溶液显碱性,则有c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。
(3)121.2g饱和碳酸钠溶液中含有碳酸钠21.2g,根据反应Na2CO3+H2O+CO2=2NaHCO3可知,通入足量的CO2后,21.2g碳酸钠可生成NaHCO3的质量为33.6g,NaHCO3的溶解度为9.6g,因此可析出固体33.6-9.6=24g;碳酸钠转化成NaHCO3时要消耗水,21.2g碳酸钠消耗水3.6g,减少的水中溶解的NaHCO3质量为0.345g,因此共析出NaHCO3质量为24.3g。
(4)通过实验②③对比,可知沉淀可溶于过量的乙,四种溶液产生的沉淀可溶于其中一种溶液的,是Al(OH)3与NaOH,因此甲为AlCl3,乙为NaOH。
考点:考查元素化合物的转化,离子浓度比较,溶解度的计算。


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省稳派名校学术联盟高三12月调研考试理综化学试卷(解析版) 题型:填空题
已知:A为淡黄色固体,E、X常温下为气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。
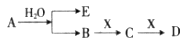
请回答下列问题:
(1)B中所含化学键的类型是______________;
(2)常温常压下,7.8g A与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式____________________。
(3)①C也可转化为B,写出该转化的化学方程式_______________;
②B与D反应的离子方程式为__________________________。
(4)将一定量的气体X通入2L B的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。

请回答:a点溶液中所含溶质的化学式为__________,b点溶液中各离子浓度由大到小的关系是___________________。
(5)将C溶液与氢氧化钡溶液混合可得不溶物F,F的 =2.5×
=2.5×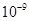 。现将该沉淀放入0.5 mol·
。现将该沉淀放入0.5 mol· 的BaCl2溶液中,其
的BaCl2溶液中,其 ________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol·
________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol· 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com