
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;分析 由元素在周期表中的位置可知,①为C,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为K,⑩为Br,
(1)室温下其单质为液态的为溴,原子核外有4的电子层,最外层电子数为7;
(2)上述元素中Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,K的金属性最强,则KOH的碱性最强;
(3)②⑧⑩三种元素的氢化物中HF含有氢键,沸点最高,HCl、HBr都不含氢键,相对分子质量越大,沸点越高;
(4)铝单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,Si单质是能与NaOH溶液反应生成H2;
(5)在②③④⑤⑦⑧元素中,原子半径最大的序号是⑧,⑤为同周期离子半径最小的元素,且核外电子排布排布相同的离子,核电荷数越大离子半径越小;
(6)可通过单质之间的置换反应证明阴离子还原性的强弱.
解答 解:由元素在周期表中的位置可知,①为C,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为K,⑩为Br,
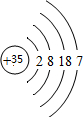
(1)室温下其单质为液态的为溴,原子核外有4的电子层,最外层电子数为7,原子结构示意图为 ,故答案为:⑩;
,故答案为:⑩; ;
;
(2)上述元素中Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,K的金属性最强,则KOH的碱性最强,
故答案为:HClO4;KOH;
(3)②⑧⑩三种元素的氢化物中HF含有氢键,沸点最高,HCl、HBr都不含氢键,相对分子质量越大,沸点越高,则沸点最低的为HCl,故答案为:HCl;
(4)铝单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,Si单质是能与NaOH溶液反应生成H2,反应的化学方程式为Si+2NaOH+H2O=Na2SiO3+2H2↑,
故答案为:⑤;⑥;Si+2NaOH+H2O=Na2SiO3+2H2↑;
(5)在②③④⑤⑦⑧元素中,原子半径最大的序号是⑧,⑤为同周期离子半径最小的元素,且核外电子排布排布相同的离子,核电荷数越大离子半径越小,则最小的为⑤,
故答案为:⑧;⑤;
(6)可通过单质之间的置换反应证明阴离子还原性的强弱,反应如Br2+S2-═2Br-+S,故答案为:Br2+S2-═2Br-+S.
点评 本题考查位置、结构、性质的应用,元素的推断较简单,学生熟悉元素在周期表中的位置及元素、单质、化合物的性质即可解答,题目难度不大.


科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
下列有关阿伏伽德罗定律的说法不正确的是
A.同温同压下,相同质量的NO和C2H4(气体)体积相同
B.同温同压下,气体的密度之比等于摩尔质量之比
C.同 温同压下,相同体积的H2和CO2的原子数之比为2:3
温同压下,相同体积的H2和CO2的原子数之比为2:3
D.同温同体积的气体,若物质的量相同则压强相同
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
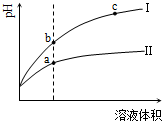
| A. | Ⅱ为盐酸稀释时的pH变化曲线 | |
| B. | a点Kw的数值比c点Kw的数值大 | |
| C. | b点酸的总浓度小于a点酸的总浓度 | |
| D. | b点溶液的导电性比c点溶液的导电性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl?NH4++Cl- | B. | H2S?2H++S2- | ||
| C. | K2CO3?2K++CO32- | D. | CH3COONH4=NH4++CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1 mol NH3分子 | B. | 含NH3和NH4+之和为1mol | ||
| C. | 含NH3、NH4+、NH3•H2O之和为1 mol | D. | 含NH3•H2O 1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
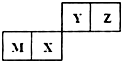
| A. | M与Z形成的化合物中只存在离子键 | |
| B. | X的最简单气态氢化物的热稳定性比Z的强 | |
| C. | 原子半径Z>Y | |
| D. | M的最高价氧化物对应水化物能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.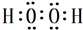 ,试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式Cu+2H++H2O2=Cu2++2H2O.
,试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式Cu+2H++H2O2=Cu2++2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com