
| A. | 大力开发新能源和可再生能源 | |
| B. | 城市大力发展轨道交通,少开私家车 | |
| C. | 清洁燃煤、提高燃油质量 | |
| D. | 学校、家庭安装空气净化装置 |
分析 A、开发新能源和可再生能源,减少化石燃料的燃烧;
B、城市大力发展轨道交通,少开私家车,减少尾气的排放;
C、清洁燃煤、提高燃油质量,可以减少有害气体的排放;
D、安装空气净化装置,不能减少空气中的有害气体.
解答 解:A、开发新能源和可再生能源,减少化石燃料的燃烧,可以减少有害气体的排放,有利于改善大气环境,故A正确;
B、城市大力发展轨道交通,少开私家车,减少尾气的排放,有利于改善大气环境,故B正确;
C、清洁燃煤、提高燃油质量,可以减少有害气体的排放,有利于改善大气环境,故C正确;
D、安装空气净化装置,不能减少空气中的有害气体,不利于改善大气环境,故D错误.
故选:D.
点评 本题考查化学与环境等问题,题目难度不大,注意相关基础知识的积累.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | H2[PtCl2(OH)4]具有很强的碱性 | B. | 3种含铂化合物的配位数均为6 | ||
| C. | 3种含铂化合物都属于共价化合物 | D. | 3种含铂配合物中Pt的化合价不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
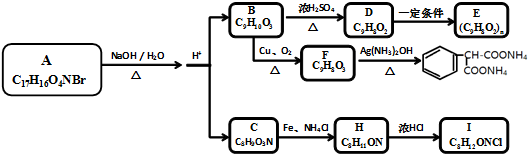
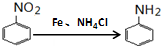
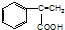 ,C→H的反应类型是还原反应.
,C→H的反应类型是还原反应.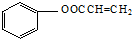 ,
,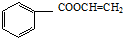 .
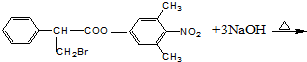
.
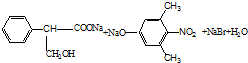 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
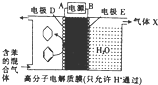 一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )
一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )| A. | A为电源的正极 | |
| B. | 气体X为H2 | |
| C. | 电极E为阴极 | |
| D. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
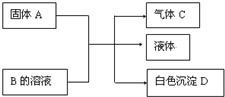 (1)A、B、C、D均为中学化学常见的物质,其组成元素均为主族元素.它们间的反应关系如图所示.
(1)A、B、C、D均为中学化学常见的物质,其组成元素均为主族元素.它们间的反应关系如图所示.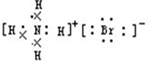 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由SO2制亚硫酸钠:SO2$\stackrel{Na_{2}CO_{3}溶液}{→}$NaHSO3溶液$→_{调节溶液的pH}^{NaOH溶液}$Na2SO3溶液 | |
| B. | 由NaCl制漂白粉精:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{澄清石灰水}{→}$漂粉精 | |
| C. | 由NH3制硝酸:NH3$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| D. | 由乙烯制乙酸:H2C=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{△}^{CuO_{2}}$CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知A-+H2B(过量)=HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 在25℃时,将cmol/L的醋酸溶液与0.02mol/LNaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) | |
| C. | 若将CO2 通入0.1 mol/LNaOH溶液中至溶液中性,则溶液中2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol/L | |
| D. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SnH4>GeH4>SiH4>CH4 | B. | SbH3>AsH3>PH3>NH3 | ||
| C. | HI>HBr>HCl>HF | D. | H2Te>H2Se>H2S>H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com