
| A. | 次氯酸具有强氧化性,可以起到除去水中悬浮的杂质和杀菌消毒作用 | |
| B. | 为防止中秋月饼等富脂食品氧化变质,常在包装中放入生石灰 | |
| C. | 金属汞一旦洒落在地面或桌面时,必须尽可能收集,并深埋处理 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
分析 A、次氯酸能够杀菌消毒,不能除去水中杂质;
B、生石灰是干燥剂,能吸水,但是不能吸收氧气;
C、金属汞一旦洒落在实验室地面或桌面时,应加入硫磺粉吸收;
D、铝常温下能与空气中氧气反应,生成一层致密的氧化物保护膜,从而具有抗腐蚀性,结合铝合金材料性质分析.
解答 解:A、氯气溶于水生成的次氯酸有强氧化性,可以起到杀菌消毒作用,但不能除去水中杂质,故A错误;
B、生石灰是干燥剂,能吸水,但是不能吸收氧气,所以加入生石灰不能防止中秋月饼等富脂食品氧化变质,故B错误;
C、金属汞一旦洒落在实验室地面或桌面时,应加入硫磺粉,故C错误;
D、铝常温下能与空气中氧气反应,生成一层致密的氧化物保护膜,从而具有抗腐蚀性,铝合金材料的密度小,用以减轻列车质量,铝合金强度大,所以高铁车厢大部分材料采用铝合金,故D正确;
故选:D.
点评 本题考查了明矾净水的原理,对汞的处理、节煤技术的理解,铝合金材料的性质等,与社会生活接触密贴,是高考的热点题型,平时学习时注意积累.


科目:高中化学 来源: 题型:选择题
| A. | .NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热 | |
| B. | .KNO3溶液(AgNO3):加过量KCl溶液,过滤 | |
| C. | .NaCl溶液(Br2):加CCl4,分液 | |
| D. | .FeSO4溶液(CuSO4):加过量铁粉、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.根据要求回答下列问题:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.根据要求回答下列问题: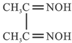 )作用生成腥红色配合物沉淀A.
)作用生成腥红色配合物沉淀A.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3加热分解转化为Na2CO3 | |
| B. | 在水中的溶解度:Na2CO3比NaHCO3大 | |
| C. | 与同浓度的稀硫酸反应时,Na2CO3比NaHCO3剧烈 | |
| D. | NaHCO3能与NaOH反应,而Na2CO3不能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com