
| A. | 钠与氧气 | B. | 氢氧化钠和二氧化碳 | ||
| C. | 氢氧化钠和氯化铝 | D. | 氧化钠和二氧化碳 |
分析 A.钠在氧气中放置生成氧化钠,在氧气中点燃生成过氧化钠;
B.氢氧化钠和二氧化碳1:1反应生成碳酸氢钠,按照2:1反应生成碳酸钠;
C.氯化铝和少量氢氧化钠溶液反应生成白色沉淀,和过量氢氧化钠溶液反应时先生成沉淀后沉淀溶解;
D.氧化钠和二氧化碳反应,无论二氧化碳是否过量,都只生成碳酸钠.
解答 解:A.钠在氧气中放置生成氧化钠,在氧气中点燃生成过氧化钠,反应条件不同产物不同,故A错误;
B.氢氧化钠和二氧化碳1:1反应生成碳酸氢钠,按照2:1反应生成碳酸钠,反应物用量不同,产物不同,故B错误;
C.氯化铝和少量氢氧化钠溶液反应生成氢氧化铝白色沉淀,和过量氢氧化钠溶液反应时,先生成氢氧化铝沉淀,然后氢氧化铝再和氢氧化钠反应生成可溶性的偏铝酸钠,溶液又变澄清,所以与反应物用量有关,故C不选;
D.无论二氧化碳是否过量,氧化钠和二氧化碳反应都只生成碳酸钠,所以与温度、反应物用量无关,故D选;
故选D.
点评 本题考查了反应条件或反应物的用量对反应的影响,题目难度不大,熟悉物质的性质是解题的关键.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
| X的基态原子中电子分布在三个不同的能级中且每个能级中电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是周期数的三倍 |
| W原子的第一至第六电离能分别为: I1=578kJ•mol-1 I2=1 817kJ•mol-1 I3=2 745kJ•mol-1 I4=11 575kJ•mol-1 I5=14 830kJ•mol-1 I6=18 376kJ•mol-1 |
| Q为前四周期中电负性最小的元素 |
| R位于周期表中的第11列 |
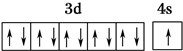 ,R在周期表中位于ds区.
,R在周期表中位于ds区.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
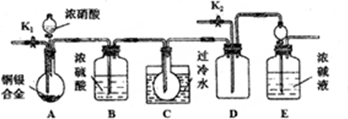
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 氢氧化镁 | 银 | |
| 化学式 | HNO3 | Mg(OH)2 | |
| 类别 | 酸 | 单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
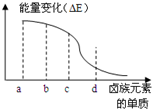 卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:
卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
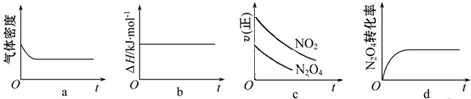
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径A<B<C | |
| B. | A、B、C的固态氧化物分别是分子晶体、离子晶体和原子晶体 | |
| C. | A单质的熔点高于C单质 | |
| D. | A与B或C均可形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液中加入少量碳酸氢钙溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 氯气和水反应:Cl2+H2O═2H++Cl-+Cl-+ClO- | |
| C. | 二氧化硅与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com