
 管并使滴定管尖嘴充满液体
管并使滴定管尖嘴充满液体  ___
___ 响”)___________________
响”)___________________
| 滴定次数 | 待测液体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.11 | B.5.5 | C.11.3 | D.10.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
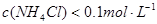 时,溶液的pH
时,溶液的pH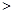 5.1,现用
5.1,现用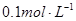 盐酸滴定20mL
盐酸滴定20mL 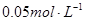 氨水,用甲基橙作指示剂,达到终点时所用盐酸的量是( )
氨水,用甲基橙作指示剂,达到终点时所用盐酸的量是( )| A.10mL | B.5mL | C.大于10mL | D.小于5mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为: 算过程)
算过程)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B.0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1 |
C. 1.0×10-3 mol/L盐酸的pH=3.0, 1.0×10-8 mol/L盐酸的pH=8.0 1.0×10-3 mol/L盐酸的pH=3.0, 1.0×10-8 mol/L盐酸的pH=8.0 |
| D.若1mLpH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 时,放出445KJ热量,则下列热化学方程式正确的是
时,放出445KJ热量,则下列热化学方程式正确的是 g)= 1/2CO2(g)
g)= 1/2CO2(g)  +H2O(l) △H=-890KJ/mol
+H2O(l) △H=-890KJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com