
A.BF3 B.H2O C.SiCl4 D.PCl5
C
解析:判断原子是否满足8电子结构的关键是要知道化合物结构,通过结构式,弄清该原子的成键数,从而判断化合物中原子最外层电子数。计算方法是:化合物中该原子最外层电子数=未成键时原子的最外层电子数+该原子成键形成共价键数(或化合价绝对值)。该题各选项中,F、O、Cl都达到最低负价,都达到8电子结构,而A选项中的B有3个共价键(或化合价为+3),所以化合物BF3中B的最外层电子数为6个,B选项H2O中H最外层达到2电子。C选项SiCl4中Si有4个共价键,达到8电子,而D选项中P形成5个共价键,化合物中P在此化合物中最外层有5+5=10个电子。该类问题难点是对一些陌生的物质不能判断出元素化合价,弄不清该原子成键形成共价键数而出错。或受CO2、SiCl4等的影响而误认为成键原子的最高价态才达到8电子稳定结构,从而错选SF6、PCl5等。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
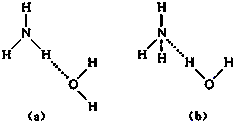 完成下列各题
完成下列各题 NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com